题目内容
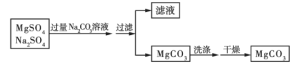
【题目】某同学以一种工业废渣(主要成分为MgCO3和少量C、Al2O3、FeSO4等)为原料制备MgCO3·3H2O,其设计的实验流程如下:
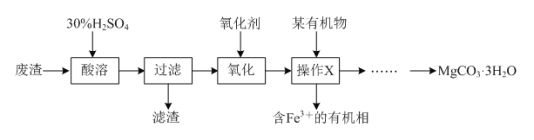
(1)质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为__________。
(2)滤渣的化学式为________;操作X的名称为__________,该操作需要的玻璃仪器是___________。
(3)已知:在下列实验中,当溶液中pH=8.5时,Mg(OH)2开始沉淀;pH=5.0时,Al(OH)3沉淀完全。请补充完整由操作X得到的水溶液制备MgCO3·3H2O的实验方案:边搅拌边向溶液中滴加氨水,________,过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
【答案】3.6 mol·L-1 C 萃取、分液 分液漏斗、烧杯 至pH介于5.0~8.5之间,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀
【解析】
由流程图可知,向工业废渣中加入30%硫酸,MgCO3和Al2O3与硫酸反应溶解,FeSO4溶解,C不反应,则过滤后得到含有镁离子、铝离子和亚铁离子的滤液和碳滤渣;向滤液中加入氧化剂,将亚铁离子氧化为铁离子,再加入有机溶剂,萃取分液除去溶液中的铁离子,得到含有镁离子、铝离子的水溶液,向水溶液中溶液中滴加氨水,控制溶液pH在5.0~8.5之间除去铝离子,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O。
(1)由c=![]() 可得质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为
可得质量分数为30%的稀硫酸(密度是1.176 g·cm-3)的物质的量浓度为![]() =3.6mol/L,故答案为:3.6mol/L;
=3.6mol/L,故答案为:3.6mol/L;
(2)由分析可知,滤渣为不溶于水,不能与30%硫酸反应的碳,化学式为C;操作X的目的为加入有机溶剂,萃取分液除去溶液中的铁离子,分液用到的仪器:分液漏斗、烧杯;故答案为:C;萃取、分液;分液漏斗、烧杯;
(3)由当溶液中pH=8.5时,Mg(OH)2开始沉淀,pH=5.0时,Al(OH)3沉淀完全可知,由操作X得到的水溶液制备MgCO3·3H2O时,应先加入氨水控制溶液pH在5.0~8.5之间除去铝离子,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀过滤、用水洗涤固体2-3次,在50℃下干燥,得到MgCO3·3H2O,故答案为:至pH介于5.0~8.5之间,过滤,向滤液中滴加Na2CO3溶液至Mg2+完全沉淀。

【题目】氯化亚砜(SOCl2)常用于医药、农药、染料工业,也可在有机合成工业中作氯化剂。已知:SOCl2的相关性质如下表所示:
颜色、状态 | 熔点 | 沸点 | 腐蚀性 | 水解 |
无色或微黄液体 | -105℃ | 78℃ | 强 | 极易水解 |
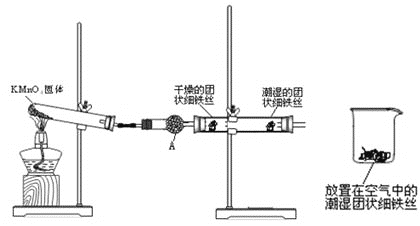
现利用如图装置制备SOCl2。

请回答下列问题:
Ⅰ.制备SO2和Cl2。
(1)本实验选用装置甲制备SO2和Cl2,装置甲中仪器x的名称为___;若以KMnO4和浓盐酸反应制备Cl2,反应的离子方程式为___。
Ⅱ.制备SOCl2。
以活性炭作为催化剂,SO2和C12可以和S粉在180~200℃时反应合成SOCl2,选用装置A、B、C、D进行制备(夹持、加热装置略去)。
(2)按气流从左到右的方向,装置A、B、C、D的连接顺序为___(填仪器接口的字母编号)。
(3)试剂y为___(填选项字母,下同);试剂z为___。
A.热水 B.乙醇 C.石蜡油 D.冰水
(4)装置A中U形管内发生反应的化学方程式为___。
(5)装置C的作用为___;若装置A处通入的SO2和Cl2的物质的量之比为1:3,则装置C中生成的盐为___(填化学式);请设计实验验证装置C中生成的盐中含有SO42-:____。