题目内容
【题目】二甲醚(CH3OCH3)是一种新兴化工原料,具有甲基化反应性能。
l.二甲醚的生产:
二甲醚的生产原理之一是利用甲醇脱水成二甲醚,化学方程式如下:
反应i 2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
(1)已知:甲醇、二甲醚的气态标准燃烧热分别为-761.5kJ·mol-1、-1455.2kJ·mol-1,且H2O(g)=H2O(1) △H=-44.0kJ·mol-1。
反应i的△H1=___________ kJ·mol-1。
(2)反应i中甲醇转化率、二甲醚选择性的百分率与不同催化剂的关系如图1所示,生产时,选择的最佳催化剂是___________。


(3)选定催化剂后,测得平衡时的甲醇转化率与温度的关系如图2所示。经研究产物的典型色谱图发现该过程主要存在的副反应为:
反应ii 2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2=-29.1kJ·mol-1
C2H4(g)+2H2O(g) △H2=-29.1kJ·mol-1
①工业上生产二甲醚的温度通常在270-300℃,高于330℃之后,甲醇转化率下降,根据化学平衡移动原理分析原因是______________________;根据化学反应速率变化分析原因是______________________。
②某温度下,以CH3OH(g)为原料,平衡时各物质的分压数据如下表:

则反应i中,CH3OH(g)的平衡转化率α=___________,反应i的平衡常数Kp=__________(用平衡分压代替平衡浓度计算;结果保留两位有效数字)
Ⅱ.二甲醚的应用:
(4)图3为绿色电源“直接二甲醚燃料电池”的工作原理示意图:
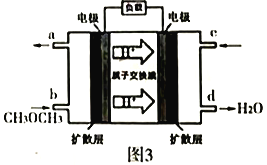
①该电池的负极反应式为:______________________;
②若串联该燃料电池电解硫酸钠溶液,消耗4.6g二甲醚后总共可在电解池两极收集到13.44L(标况)气体,该套装置的能量利用率为___________。(保留3位有效数字)
【答案】-23.8 GiSNL-108 该反应是放热反应,温度升高,平衡逆向移动,转化率下降 温度升高,催化剂失活,对二甲醚的选择性下降,转化率下降(回答“温度升高,催化剂失活,副反应增多”也得分) 75% 3.6 CH3OCH3-12e-+3H2O=2CO2+12H+ 66.7%
【解析】
(1)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-761.5kJ·mol-1,
O2(g)=CO2(g)+2H2O(l) △H=-761.5kJ·mol-1,
②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455.2kJ·mol-1,
③H2O(g)=H2O(1) △H=-44.0kJ·mol-1,
根据盖斯定律:①![]() 2- ②-③计算;
2- ②-③计算;
(2)由图1可知,反应i中甲醇转化率、二甲醚选择性的百分率以催化剂GiSNL-108为最佳;
(3)①工业上生产二甲醚的反应是放热反应,温度升高,平衡逆向移动,转化率下降;从化学反应速率变化分析,温度升高,催化剂失活,对二甲醚的选择性下降,转化率下降;
②用平衡分压代替平衡浓度列出三行式,找出起始时CH3OH的总量以及转化为二甲醚的量,计算转化率;用平衡分压代替平衡浓度,根据Kp=![]() 计算平衡常数;
计算平衡常数;
(4)①原电池负极发生氧化反应,由图可知,溶液为酸性条件,二甲醚失电子生成二氧化碳,写出电极反应式;
②根据能量利用率=![]() 100%计算。
100%计算。
(1)已知:①CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) △H=-761.5kJ·mol-1,
O2(g)=CO2(g)+2H2O(l) △H=-761.5kJ·mol-1,
②CH3OCH3(g)+3O2(g)=2CO2(g)+3H2O(l) △H=-1455.2kJ·mol-1,
③H2O(g)=H2O(1) △H=-44.0kJ·mol-1,
根据盖斯定律:①![]() 2- ②-③得:2CH3OH(g)
2- ②-③得:2CH3OH(g)![]() CH3OCH3(g)+H2O(g) 的△H1=(-761.5kJ·mol-1)
CH3OCH3(g)+H2O(g) 的△H1=(-761.5kJ·mol-1)![]() -(-1455.2kJ·mol-1)-(-44.0kJ·mol-1)= -23.8kJ·mol-1;
-(-1455.2kJ·mol-1)-(-44.0kJ·mol-1)= -23.8kJ·mol-1;
因此,本题正确答案为:-23.8;
(2) 由图1可知,反应i中甲醇转化率、二甲醚选择性的百分率以催化剂GiSNL-108为最佳;
因此,本题正确答案为:GiSNL-108;
(3)①工业上生产二甲醚的反应是放热反应,温度升高,平衡逆向移动,转化率下降,所以高于330℃之后,甲醇转化率下降;从化学反应速率变化分析,温度升高,催化剂失活,对二甲醚的选择性下降,转化率下降;
②用平衡分压代替平衡浓度列出三行式:
2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
起始量 0.736 0 0
转化量 0.576 0.288 0.288
平衡量 0.16 0.288
由方程式2CH3OH(g)![]() C2H4(g)+2H2O(g)可知转化为C2H4的CH3OH的量为0.016
C2H4(g)+2H2O(g)可知转化为C2H4的CH3OH的量为0.016![]() 2=0.032,
2=0.032,
所以起始时CH3OH的总量为0.736+0.032=0.768,其他条件相同时,压强之比等于物质的量之比,
则反应i中,CH3OH(g)的平衡转化率α=![]() 100%=75%,
100%=75%,
由方程式2CH3OH(g)![]() C2H4(g)+2H2O(g)可知反应ii转化为H2O的量为0.016
C2H4(g)+2H2O(g)可知反应ii转化为H2O的量为0.016![]() 2=0.032,
2=0.032,
则平衡时H2O(g)平衡分压为:0.288MPa+0.032 MPa=0.32 MPa,
反应i的平衡常数Kp=![]() =
=![]() =3.6,
=3.6,
因此,本题正确答案为:该反应是放热反应,温度升高,平衡逆向移动,转化率下降;温度升高,催化剂失活,对二甲醚的选择性下降,转化率下降;75%;3.6;
(4)①原电池负极发生氧化反应,由图可知,溶液为酸性条件,二甲醚失电子生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②电解硫酸钠溶液两极生成氢气和氧气,若两极收集到13.44L(标况)气体,生成气体的物质的量为![]() =0.6mol,生成的氢气和氧气的体积比为2:1,则阴极产生0.4molH2,阳极产生0.2molO2,电路中转移电子为0.2mol
=0.6mol,生成的氢气和氧气的体积比为2:1,则阴极产生0.4molH2,阳极产生0.2molO2,电路中转移电子为0.2mol![]() 4=0.8mol;
4=0.8mol;
由燃料电池电极反应CH3OCH3-12e-+3H2O=2CO2+12H+可知,消耗4.6g二甲醚转移电子为![]() 12=1.2mol,
12=1.2mol,
所以能量利用率为![]() 100%=66.7%。
100%=66.7%。
因此,本题正确答案为:CH3OCH3-12e-+3H2O=2CO2+12H+;66.7%。