题目内容
A、B、PX均为石油化工类产品,其中PX是无色透明的芳烃类化合物,毒性略高于乙醇,主要用来生产塑料、聚酯纤维PET和薄膜,其生产流程如图.
已知:
(1)A、B是两种平面结构的烃.
(2)核磁共振氢谱显示C分子中仅有一种氢,PX分子中有2种氢.
(3)D能与NaHCO3溶液反应,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧.请同答:
(1)工业上获得A的主要途径是 ,B的电子式为 .
(2)A→PX的化学方程式为 .
(3)C的结构简式为 .
(4)D有多种同分异物体,写出满足下列条件的一种芳香同分异构体结构简式 .
①能与FeCl3发生显色反应;②发生银镜反应;③能发生水解反应.1mol该物质与NaOH溶液在一定条件下充分反应,可消耗 mol NaOH.
(5)D+E→PET的化学方程式为 .该反应类型为 .

已知:
(1)A、B是两种平面结构的烃.
(2)核磁共振氢谱显示C分子中仅有一种氢,PX分子中有2种氢.
(3)D能与NaHCO3溶液反应,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧.请同答:
(1)工业上获得A的主要途径是
(2)A→PX的化学方程式为
(3)C的结构简式为
(4)D有多种同分异物体,写出满足下列条件的一种芳香同分异构体结构简式
①能与FeCl3发生显色反应;②发生银镜反应;③能发生水解反应.1mol该物质与NaOH溶液在一定条件下充分反应,可消耗
(5)D+E→PET的化学方程式为
考点:有机物的推断
专题:有机物的化学性质及推断
分析:B是平面结构的烃,氧化得到C(C2H4O),可推知B为CH2=CH2,C为 ,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
=8、H原子数目=
=6、O原子数目=
=4,故D的分子式为C8H6O4,PX是无色透明的芳烃类化合物,A是平面结构的烃,A进行甲基化生成PX,结合转化关系,可推知A为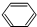 ,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为
,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为 ,结合D分子式可知PX氧化性生成D,故D为
,结合D分子式可知PX氧化性生成D,故D为 ,聚酯纤维PET为
,聚酯纤维PET为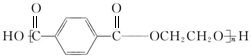 ,据此解答.
,据此解答.
 ,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=| 166×57.8% |
| 12 |
| 166×3.6% |
| 1 |
| 166-12×8-6 |
| 16 |
 ,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为
,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为 ,结合D分子式可知PX氧化性生成D,故D为
,结合D分子式可知PX氧化性生成D,故D为 ,聚酯纤维PET为
,聚酯纤维PET为 ,据此解答.
,据此解答.解答:
解:B是平面结构的烃,氧化得到C(C2H4O),可推知B为CH2=CH2,C为 ,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
=8、H原子数目=
=6、O原子数目=
=4,故D的分子式为C8H6O4,PX是无色透明的芳烃类化合物,A是平面结构的烃,A进行甲基化生成PX,结合转化关系,可推知A为 ,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为
,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为 ,结合D分子式可知PX氧化性生成D,故D为
,结合D分子式可知PX氧化性生成D,故D为 ,聚酯纤维PET为
,聚酯纤维PET为 ,
,
(1)A为 ,工业上获得A的主要途径是催化重整,B为CH2=CH2,电子式为
,工业上获得A的主要途径是催化重整,B为CH2=CH2,电子式为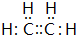 ,
,
故答案为:催化重整;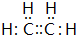 ;
;
(2)A→PX的化学方程式为: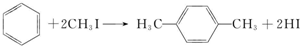 ,
,
故答案为: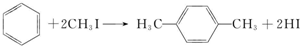 ;
;
(3)由上述分析可知,C的结构简式为 ,故答案为:
,故答案为: ;
;
(4)D为 ,满足下列条件的一种芳香同分异构体:①能与FeCl3发生显色反应,说明含有酚羟基;②发生银镜反应,含有-CHO;③能发生水解反应,含有酯基,符合条件的一种同分异构体为:
,满足下列条件的一种芳香同分异构体:①能与FeCl3发生显色反应,说明含有酚羟基;②发生银镜反应,含有-CHO;③能发生水解反应,含有酯基,符合条件的一种同分异构体为: 等,酚羟基能与氢氧化钠反应、酯基水解得到酚羟基、羧酸都能与氢氧化钠反应,故1mol该物质与NaOH溶液在一定条件下充分反应,可消耗3mol NaOH,
等,酚羟基能与氢氧化钠反应、酯基水解得到酚羟基、羧酸都能与氢氧化钠反应,故1mol该物质与NaOH溶液在一定条件下充分反应,可消耗3mol NaOH,
故答案为: 等;3;
等;3;
(5)D+E→PET的化学程式为: ,属于缩聚反应,
,属于缩聚反应,
故答案为: ,缩聚反应.
,缩聚反应.
 ,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=
,C与水发生反应生成E为CH3CH2OH.D能与NaHCO3溶液反应,含有-COOH,质谱图表明D的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧,故D分子中C原子数目=| 166×57.8% |
| 12 |
| 166×3.6% |
| 1 |
| 166-12×8-6 |
| 16 |
 ,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为
,而PX分子中有2种氢,应是苯分子对位位置的2个H原子被甲基取代生成PX,故PX为 ,结合D分子式可知PX氧化性生成D,故D为
,结合D分子式可知PX氧化性生成D,故D为 ,聚酯纤维PET为
,聚酯纤维PET为 ,
,(1)A为
 ,工业上获得A的主要途径是催化重整,B为CH2=CH2,电子式为
,工业上获得A的主要途径是催化重整,B为CH2=CH2,电子式为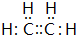 ,
,故答案为:催化重整;
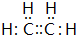 ;
;(2)A→PX的化学方程式为:
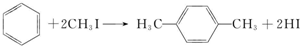 ,
,故答案为:
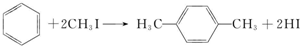 ;
;(3)由上述分析可知,C的结构简式为
 ,故答案为:
,故答案为: ;
;(4)D为
 ,满足下列条件的一种芳香同分异构体:①能与FeCl3发生显色反应,说明含有酚羟基;②发生银镜反应,含有-CHO;③能发生水解反应,含有酯基,符合条件的一种同分异构体为:
,满足下列条件的一种芳香同分异构体:①能与FeCl3发生显色反应,说明含有酚羟基;②发生银镜反应,含有-CHO;③能发生水解反应,含有酯基,符合条件的一种同分异构体为: 等,酚羟基能与氢氧化钠反应、酯基水解得到酚羟基、羧酸都能与氢氧化钠反应,故1mol该物质与NaOH溶液在一定条件下充分反应,可消耗3mol NaOH,
等,酚羟基能与氢氧化钠反应、酯基水解得到酚羟基、羧酸都能与氢氧化钠反应,故1mol该物质与NaOH溶液在一定条件下充分反应,可消耗3mol NaOH,故答案为:
 等;3;
等;3;(5)D+E→PET的化学程式为:
 ,属于缩聚反应,
,属于缩聚反应,故答案为:
 ,缩聚反应.
,缩聚反应.
点评:本题考查有机物推断与合成,计算确定D的分子式是推断关键,再结合转化关系及各物质的结构特点进行推断,对学生的逻辑推理有较高的要求,需要学生具备扎实的基础,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设为阿伏伽德罗常数的值,下列有关叙述正确的是( )
| A、100mL 18mol?L-1浓硫酸与足量铜反应,转移电子数为1.8NA |
| B、0.5L 0.2mol?L-1氯化铁溶液中Fe3+数目为0.1NA |
| C、0.4mol SiO2晶体中所含的共价键数目为1.6NA |
| D、已知t℃时,MgCO3的K=4.0×10-6,则MgCO3饱和溶液中含Mg2+数目为2×10-3NA |
下列各组失去标签的溶液,不另加其他试剂(仅利用组内物质间的反应),运用试管和胶头滴管就能区别开来的是( )
| A、FeCl3、NaOH、KSCN、Ba(NO3)2 |
| B、NaCl、Na2CO3、KNO3、HCl |
| C、BaCl2、Na2SO4、NaOH、NaCl |
| D、Na2SO4、BaCl2、K2CO3、KNO3 |
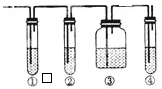 实验室中通常用浓硫酸使乙醇脱水制取少量乙烯,反应机理如为:CH3CH2OH→C2H4↑+H2O.实验中常因温度过高使乙醇与浓硫酸反应生成少量的二氧化硫气体.有人设计了如图的实验,以确定上述混合气体中是否含有乙烯和二氧化硫.
实验室中通常用浓硫酸使乙醇脱水制取少量乙烯,反应机理如为:CH3CH2OH→C2H4↑+H2O.实验中常因温度过高使乙醇与浓硫酸反应生成少量的二氧化硫气体.有人设计了如图的实验,以确定上述混合气体中是否含有乙烯和二氧化硫. 近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.
近年来,由于温室效应和资源短缺等问题,关于CO2和碳酸盐应用的研究受到人们的重视.某研究小组利用反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,制备CO2与H2 的混合气体,并进一步研究CO2与H2以不同的体积比混合时在合适条件下的反应产物应用.