题目内容
【题目】完成下列填空:
(1)与标准状况下4.48LCO2中所含氧原子数目相同的水的质量是_______g;
(2)V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为_____mol/L;
(3)用容量瓶配制一定物质的量浓度的稀硫酸,下面操作造成所配稀硫酸溶液浓度偏高的是________
A.转移时没有洗涤烧杯、玻璃棒
B.未冷却到室温就转移
C.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶
E.定容时俯视液面
(4)下列属于电解质的是___________,属于非电解质的是__________(填编号)。
①酒精 ②CH3COOH ③NaOH ④NaCl ⑤Cu ⑥SO2 ⑦Na2CO3
(5)药物“达喜”的化学成分是铝和镁的碱式盐,可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为_______。
【答案】7.2 ![]() BDF ②③④⑦ ①⑥ 16:1
BDF ②③④⑦ ①⑥ 16:1
【解析】
(1)根据n=![]() 结合物质的分子构成计算;
结合物质的分子构成计算;
(2)根据Fe3+的质量求其物质的量,根据化学式计算SO42-的物质的量,然后利用物质的量浓度定义式计算其物质的量浓度;
(3)分析操作对溶质的物质的量或对溶液的体积的影响,根据c=![]() 分析对所配溶液浓度的影响;
分析对所配溶液浓度的影响;
(4)根据电解质、非电解质的概念分析判断;
(5)加入盐酸生成CO2,反应过程为:先发生H++OH-=H2O,再发生CO32-+H+=HCO3-,最后发生HCO3-+H+=CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+=CO2↑+H2O,根据方程式计算n(HCO3-)、n(CO32-),进而计算HCO3-、CO32-消耗的氢离子物质的量,进而计算n(OH-),据此解答。
(1)标准状况下4.48L CO2的物质的量n(CO2)=![]() =0.2mol,其中含有O原子的物质的量为0.4mol,由于H2O分子中只含有1个O原子,所以所含氧原子数目相同的水的物质的量为0.4mol,则水的质量为m(H2O)=0.4mol×18g/mol=7.2g;
=0.2mol,其中含有O原子的物质的量为0.4mol,由于H2O分子中只含有1个O原子,所以所含氧原子数目相同的水的物质的量为0.4mol,则水的质量为m(H2O)=0.4mol×18g/mol=7.2g;
(2)V L Fe2(SO4)3溶液中,含有Fe3+mg,则n(Fe3+)=![]() mol,根据化学式Fe2(SO4)3可知SO42-的物质的量n(SO42-)=
mol,根据化学式Fe2(SO4)3可知SO42-的物质的量n(SO42-)=![]() n(Fe3+)=
n(Fe3+)=![]() ×
×![]() mol,所以SO42-的物质的量浓度为c(SO42-)=
mol,所以SO42-的物质的量浓度为c(SO42-)=![]() =
=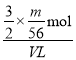 =
=![]() mol/L;
mol/L;
(3)A.转移时没有洗涤烧杯、玻璃棒,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,A错误;
B.溶解的时候溶液没有冷却到室温就转移,溶液冷却后体积偏小,导致所配制的溶液浓度偏高,B正确;
C.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线,使配制的溶液体积偏大,溶液浓度偏小,C错误;
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶,溶质的物质的量偏大,配制的溶液浓度偏高,D正确;
E.定容时俯视刻度线,导致加入的蒸馏水体积偏小,则配制的溶液体积偏小,溶液浓度偏高,E正确;
故合理选项是BDE;
(4)①酒精本身不能电离产生自由移动的离子,是化合物,属于非电解质;
②CH3COOH在水溶液中可电离产生自由移动的CH3COO-、H+,是化合物,属于电解质; ③NaOH在水溶液中或熔融状态下可电离产生自由移动的Na+、OH-,是化合物,属于电解质;
④NaCl在水溶液中或熔融状态下可电离产生自由移动的Na+、Cl-,是化合物,属于电解质;⑤Cu是单质,不是电解质,也不是非电解质;
⑥SO2本身不能电离产生自由移动的离子,是化合物,属于非电解质;
⑦Na2CO3在水溶液中或熔融状态下可电离产生自由移动的Na+、CO32-,是化合物,属于电解质;
综上所述可知。属于电解质的是②③④⑦;属于非电解质的是①⑥;
(5)加入盐酸时,反应过程为:先发生H++OH-=H2O,再发生CO32-+H+=HCO3-,最后发生HCO/span>3-+H+=CO2↑+H2O,从42.5mL~45.0mL消耗2.5mL盐酸,发生反应HCO3-+H+=CO2↑+H2O,n(HCl)=2.0 mol/L×0.0025L=0.005mol,则n(HCO3-)=0.005mol,由CO32-+H+=HCO3-可知n(CO32-)=n(HCO3-)=0.005mol,则与OH-反应的HCl消耗的H+的物质的量n(H+)=2mol/L×0.045L-0.005mol-0.005mol=0.08mol,所以该碱式盐样品中氢氧根与碳酸根的物质的量之比=0.08mol:0.005mol=16:1。