题目内容
【题目】现有部分元素的性质、用途与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
W | 周期表中原子半径最小的元素 |
X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
Y | 一种核素在考古时常用来鉴定一些文物的年代 |
Z | M层比K层少1个电子 |
T | 存在两种同素异形体,其中一种可吸收紫外线 |
(1)元素Y在周期表中的位置第 , 元素T的简单离子结构示意图 .
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 ![]() 丙+丁,该反应为: .
丙+丁,该反应为: .
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式 .
【答案】
(1)二周期ⅡA族;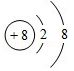
(2)![]()
(3)NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(4)N2H4+2H2O2=N2↑+4H2O
【解析】解:W是周期表中原子半径最小的元素,则W为H元素;X的氢化物可与其最高价氧化物的水化物反应生成盐,则X为N元素;Y的一种核素在考古时常用来鉴定一些文物的年代,则Y为C元素;Z的M层比K层少1个电子,则Z的M层含有1个电子,为Na元素;T存在两种同素异形体,其中一种可吸收紫外线,T为O元素,(1)元素Y为C,原子序数为6,在周期表中位于二周期ⅡA族;元素T为O,O的简单离子为氧离子,其核电荷数为8、核外电子总数为10,其离子结构示意图为:,所以答案是:二周期ⅡA族; 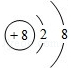 ;(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,该化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
;(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,该化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ![]() , 所以答案是:
, 所以答案是: ![]() ;(3)W、X、T分别为H、N、O元素,H与N、O形成的10电子微粒有:NH3、H2O、NH4+、OH﹣等,其中有四种微粒可以发生反应:甲+乙
;(3)W、X、T分别为H、N、O元素,H与N、O形成的10电子微粒有:NH3、H2O、NH4+、OH﹣等,其中有四种微粒可以发生反应:甲+乙 ![]() 丙+丁,反应方程式为:NH4++OH﹣
丙+丁,反应方程式为:NH4++OH﹣ ![]() NH3↑+H2O,所以答案是:NH4++OH﹣
NH3↑+H2O,所以答案是:NH4++OH﹣ ![]() NH3↑+H2O;(4)氧元素与氢元素形成的原子个数比为1:1的化合物己为H2O2 , 氮元素与氢元素形成的原子个数为1:2的化合物戊是N2H4 , 两者反应可生成X单质(N2)和另一种液体化合物(H2O),该反应的化学方程式为:N2H4+2H2O2=N2↑+4H2O,所以答案是:N2H4+2H2O2=N2↑+4H2O.
NH3↑+H2O;(4)氧元素与氢元素形成的原子个数比为1:1的化合物己为H2O2 , 氮元素与氢元素形成的原子个数为1:2的化合物戊是N2H4 , 两者反应可生成X单质(N2)和另一种液体化合物(H2O),该反应的化学方程式为:N2H4+2H2O2=N2↑+4H2O,所以答案是:N2H4+2H2O2=N2↑+4H2O.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案

