题目内容
7.某温度时,测得纯水中c(H+)=2.4×10-7 mol•L-1,则c(OH-)为( )| A. | 2.4×10-7mol•L-1 | B. | 1.0×10-7mol•L-1 | ||
| C. | $\frac{1.0×1{0}^{-14}}{2.4×10-7}$ mol•L-1 | D. | 无法确定 |
分析 当溶液中c(H+)=c(OH-),则溶液呈中性,当溶液中c(H+)>c(OH-),则溶液呈酸性,当溶液中c(H+)<c(OH-),则溶液呈碱性.根据无论在什么温度下,纯水永远显中性来分析.
解答 解:纯水呈中性,则纯水中c(H+)=c(OH-)=2.4×10-7 mol/L,故选A.
点评 本题考查弱电解质的电离及溶液酸碱性的确定,注意不能根据c(H+) 大小确定溶液是酸碱性,要根据c(H+) 和c(OH-)的相对大小确定溶液的酸碱性,为易错点.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
17.PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱.下列反应在水溶液中不可能发生的是( )
| A. | Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 10Cl-+2MnO4-+16H+═2Mn2++5Cl2↑+8H2O | |
| C. | 2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 5Pb2++2MnO4-+2H2O═5PbO2+2Mn2++4H+ |
18.在如图所示的装置中,a的金属活动性排在氢之前,b为碳棒,关于此装置的各种叙述正确的是( )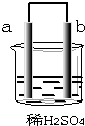

| A. | a是正极,b是负极 | |
| B. | 导线中有电子流动,电子从b极流到a极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | b极上发生了还原反应 |
15.在一定条件下的恒容密闭容器中发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),图1表示反应过程中能量的变化,图2表示反应过程中物质浓度的变化.下列有关说法正确的是( )


| A. | 该反应的焓变和熵变:△H>0,△S<0 | |
| B. | 温度降低,该反应的平衡常数K增大 | |
| C. | 升高温度,$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大 | |
| D. | 从反应开始到平衡,用氢气表示的平均反应速率为2.25 mol/(L•min) |
2.下列说法不正确的是( )
| A. | 氧化还原反应的特征是元素化合价发生了变化 | |
| B. | 在水溶液中能电离出H+的化合物不一定是酸 | |
| C. | 溶液与胶体的本质区别是能否产生丁达尔现象 | |
| D. | 因为NH3溶于水的溶液能导电,所以NH3是电解质 |
12.下列离子方程式的书写正确的是( )
| A. | 向石灰水中滴加小苏打溶液至Ca2+恰好沉淀:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| B. | 实验室用石灰石和稀盐酸反应制取CO2:CO32-+2H+=CO2↑+H2O | |
| C. | 铁粉投入到稀硝酸中:Fe+2H+=Fe2++H2↑ | |
| D. | Ba(OH)2溶液与MgSO4溶液恰好反应:Ba2++SO42-=BaSO4↓ |
19.如果花生油中混有水,最好的分离方法是( )
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
16.下列说法正确的是( )
| A. | 氧的摩尔质量是32 | B. | CO${\;}_{3}^{2-}$摩尔质量是60g/mol | ||
| C. | CO2的相对分子质量是44g | D. | 硫酸的摩尔质量是98g |
17.有一未知浓度的硫酸溶液25mL,在加入0.1mol/L BaCl2溶液10mL后,改加NaOH溶液,结果用去0.1mol/LNaOH溶液25mL恰好完全中和,则此硫酸的物质的量浓度为( )
| A. | 0.2mol/L | B. | 0.5mol/L | C. | 0.1mol/L | D. | 0.05mol/L |