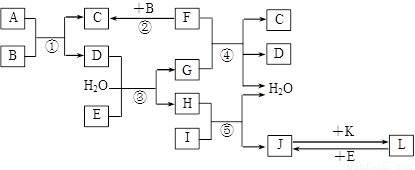
题目内容
(10分) 回答下列问题
(1)写出过氧化钙与纯碱溶液反应的化学方程式:_______________________________________________;
(2)据报道,在全国各地发生了多起将84消毒液与洁厕灵混合使用,导致氯气中毒的事件,写出该反应的离子反应方程式:_____________________________________________________________________;
(3)汞与次氯酸等物质的量发生反应,生成水和另一含汞产物,含汞产物的名称为_______________。
(4)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2。已知Fe3+氧化性比S2O82-氧化性弱,Fe2+的还原性比I-还原性弱,实验却表明Fe3+、Fe2+可催化上述反应。简述Fe3+能加快该反应速率起催化作用的原因:________________________________________________________________________________。
(5)有机分子中,四价的碳原子以一个、二个、三个或四个单键分别连接一个、二个、三个或四个其它碳原子时,被分别称为伯、仲、叔或季碳原子(也可以分别称为第一、第二、第三或第四碳原子),例如2,2,4-三甲基戊烷中有5个伯碳原子,仲、叔、季碳原子各1个。由6个叔碳原子和6个伯碳原子(其余为氢原子)构成的饱和烃有 种(不考虑顺反异构和光学异构)。
(1)2CaO2+2Na2CO3十2H2O=2CaCO3+4NaOH+O2↑(2分)![]()
![]()
(2)ClO-+Cl―+2H+=Cl2+H2O。(2分)
(3) 氯氧化汞(或碱式氯化汞)(2分)
(4)阴离子与阴离子间相互排斥,反应S2O82-+2I-=2SO42-+I2不易发生;阴离子与阳离子间相互吸引,反应2Fe3++2I-=2Fe2++I2、S2O82-+2Fe2+=2SO42-+2Fe3+容易发生,故Fe3+能加快该反应的速率而起催化作用。(2分)
(5)9(2分)

 a
a