题目内容
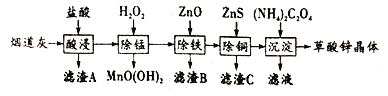
【题目】在炼锌厂和炼钢厂废弃的含锌烟道灰中,含有30%~50%的氧化锌,另含少量Fe2O3、CuO、SiO2、MnO等物质,可用该烟道灰为原料生产草酸锌晶体(ZnC2O4·2H2O)。
请回答下列问题:
(1)为了提高漫出速率,除将烟道灰处理得更细外,还可采取的措施有______ (写出一条)。
(2)证明除铁工序中Fe3+已经沉淀完全的实验步骤及现象是__________.
(3)上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是__________.
(4)己知: 常温下,Ksp[Fe(OH)3]=8.0×10-38.当加入ZnO控制反应液pH=5.0时,溶液中c(Fe3+)=_________.
(5)草酸能使酸性高锰酸钾溶液褪色,试写出相关反应的离子方程式:___________.
【答案】 升温 取除铁工序所得上层清液,滴加几滴KSCN溶液,若无变化,说明Fe3+已沉淀完全 先加ZnS会将Fe3+还原为Fe2+,使铁元素难以除去 8.0x 10-11mol/L 5H2C2O4 + 2MnO4-+6H+=2Mn2++ 10CO2↑+8H2O
【解析】(1)提高漫出速率,除将烟道灰处理得更细外,还可以提高反应的温度,加快反应速率。
(2)除铁工序中Fe3+转化为Fe(OH)3沉淀,要证明除铁工序中Fe3+已经沉淀完全,可以取除铁工序所得的上层清液,滴加几滴KSCN溶液,若无变化,说明Fe3+已沉淀完全。
(3)除铁过程中的溶液显酸性,如果先加ZnS,溶液中将产生具有还原性的H2S,会将溶液中的Fe3+还原为Fe2+, Fe(OH)2比Fe(OH )3难沉淀,从而使Fe元素难以除去,故答案为:先加ZnS会将Fe3+还原为Fe2+,使铁元素难以除去。
(4) Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-),所以c(Fe3+)=8.0×10-38÷(10-9)3=8.0×10-11mol/L。
(5)草酸具有还原性,与强氧化剂高锰酸钾溶液反应的离子方程式为:5H2C2O4 + 2MnO4-+6H+=2Mn2++ 10CO2↑+8H2O。