题目内容
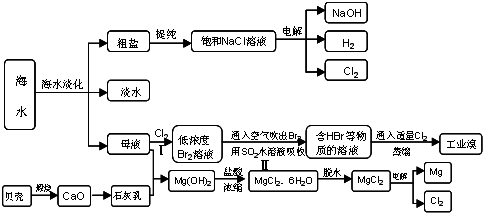
海水占地球总储水量的97.2%.若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
(1)海水中含有大量的氯化钠.请写出氯原子的原子结构示意图
 ;
;
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.电解饱和食盐水的化学方程式为
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:试写出④的化学反应方程式

(1)海水中含有大量的氯化钠.请写出氯原子的原子结构示意图


(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法.蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是
物理变化
物理变化
(填物理变化、化学变化);(3)工业上利用电解饱和食盐水可制得重要化工产品,又称为“氯碱工业”.电解饱和食盐水的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
;
| ||
(4)近年来有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法,该方法的流程如下:试写出④的化学反应方程式
NaHSO3+HCl=NaCl+SO2↑+H2O
NaHSO3+HCl=NaCl+SO2↑+H2O
.
分析:(1)根据氯原子的原子序数,写出原子结构示意图;
(2)根据蒸馏法的原理;
(3)根据电解原理写出化学方程式;
(4)根据弱酸的酸式盐能与强酸反应;
(2)根据蒸馏法的原理;
(3)根据电解原理写出化学方程式;
(4)根据弱酸的酸式盐能与强酸反应;
解答:解:(1)根据氯原子的原子序数17,则氯原子的原子结构示意图为: ,
,
(2)由于蒸馏法只是水的状态由液态到气态再到液态的过程,所以属于物理变化;
(3)根据电解原理,可得2NaCl+2H2O
2NaOH+H2↑+Cl2↑;
(4)因弱酸的酸式盐能与强酸反应:NaHSO3+HCl=NaCl+SO2↑+H2O;
故答案为:(1)
(2)物理变化
(3)2NaCl+2H2O
2NaOH+H2↑+Cl2↑
(4)NaHSO3+HCl=NaCl+SO2↑+H2O
 ,
,(2)由于蒸馏法只是水的状态由液态到气态再到液态的过程,所以属于物理变化;
(3)根据电解原理,可得2NaCl+2H2O
| ||
(4)因弱酸的酸式盐能与强酸反应:NaHSO3+HCl=NaCl+SO2↑+H2O;
故答案为:(1)

(2)物理变化
(3)2NaCl+2H2O
| ||
(4)NaHSO3+HCl=NaCl+SO2↑+H2O
点评:本题主要考查学生对海洋水资源的了解情况及对海洋资源的利用、海洋污染的防治的知识掌握情况.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目