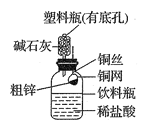
题目内容
【题目】己知:
(1)Al(OH)3的电离方程式:AlO2-+H++H2O![]() Al(OH)3
Al(OH)3![]() A13++3OH-
A13++3OH-
(2)无水AlCl3晶体的沸点:182.9℃,溶于水的电离方程式为:AlCl3=Al3++3Cl-
(3)PbSO4难溶于水,易溶于醋酸钠溶液,反应的化学方程式为:PbSO4+2CH3COONa=Na2SO4+(CH3COO)2Pb
则下列关于A1(OH)3、AlCl3和(CH3COO)2Pb的说法中正确的是( )
A.均为强电解质 B.均为弱电解质
C.均为离子化合物 D.均为共价化合物
【答案】D
【解析】
试题分析:(1)强电解质完全电离,而Al(OH)3是部分电离,因此Al(OH)3不属于强电解质,氢氧化铝两性氢氧化物,属于共价化合物,(2)AlCl3溶于水,全部电离,属于强电解质,AlCl3沸点低,(3)属于共价化合物,反应向着更难溶的方向进行,或者向着更难电离的方向进行,醋酸铅不是沉淀,因此醋酸铅属于共价化合物,故选项D正确。

练习册系列答案
相关题目