题目内容
【题目】短周期元素X、Y、Z原子半径的顺序为Z>X>Y,基态X原子p能级上的电子数是Y原子质子数的3倍,它们可以形成离子化合物![]() ,其中阳离子
,其中阳离子![]() (已知
(已知![]() 水合物的
水合物的![]() 为
为![]() 、
、![]() 为
为![]() )的结构如图所示。下列叙述错误的是
)的结构如图所示。下列叙述错误的是
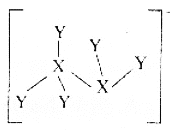
A.![]() 的阴、阳离子均含有18个电子
的阴、阳离子均含有18个电子
B.常温下,![]() 的水溶液呈碱性
的水溶液呈碱性
C.三种元素中Y的电负性最小
D.简单气态氢化物的还原性:X>Z
【答案】B
【解析】
X、Y、Z是短周期元素,基态X原子p能级上的电子数是Y原子质子数的3倍,且原子半径X>Y,根据X2Y5+离子的结构示意图可知,X为N元素,Y为H元素,又X、Y、Z可形成离子化合物X2Y5Z,且原子半径Z>X,则Z为Cl元素,据此分析解答问题。
A.X2Y5Z为N2H5Cl,化合物中阴离子为Cl-,含有18个电子,阳离子为N2H5+,含有的电子总数为7×2+1×5-1=18,A正确;
B.已知N2H4水合物的![]() 为
为![]() 、
、![]() 为
为![]() ,则N2H4的水合物N2H4·H2O为弱碱,因此常温下,N2H5Cl溶液中N2H5+水解显酸性,B错误;
,则N2H4的水合物N2H4·H2O为弱碱,因此常温下,N2H5Cl溶液中N2H5+水解显酸性,B错误;
C.非金属性越强,电负性越大,非金属性H元素最弱,故H的电负性最小,C正确;
D.X、Z的简单氢化物分别为NH3、HCl,元素非金属越强对应阴离子的还原性越弱,由于氧化性Cl>N,则NH3的还原性更强,D正确;
答案选B。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】在容积一定的密闭容器中发生可逆反应A(g)+B(g)![]() C(g) △H>0,平衡移动关系如下图所示下列说法正确的是
C(g) △H>0,平衡移动关系如下图所示下列说法正确的是
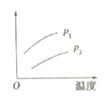
选项 | 压强 | 纵坐标 |
A | p1>p2 | B的转化率 |
B | p1<p2 | C的物质的量浓度 |
C | p1<p2 | 混合气体的平均摩尔质量 |
D | p1>p2 | A的质量分数 |
A. AB. BC. CD. D
【题目】丙酮的碘代反应![]() 的速率方程为
的速率方程为![]() ,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为
,其半衰期(当剩余反应物恰好是起始的一半时所需的时间)为![]() 改变反应物浓度时,反应的瞬时速率如表所示。
改变反应物浓度时,反应的瞬时速率如表所示。
|
|
|
0.25 | 0.050 | 1.4 |
0.50 | 0.050 | 2.8 |
1.00 | 0.050 | 5.6 |
0.50 | 0.100 | 2.8 |
下列说法正确的是( )
A.速率方程中的![]() 、
、![]()
B.该反应的速率常数![]()
C.增大![]() 的浓度,反应的瞬时速率加快
的浓度,反应的瞬时速率加快
D.在过量的![]() 存在时,反应掉87.5%的
存在时,反应掉87.5%的![]() 所需的时间是375min
所需的时间是375min