题目内容
Na2CO3, CuSO4、Na2SO4、CaCl2,NaCl, AgNO3(稀硝酸酸化)
解析试题分析:(1)将固体混合物溶于水,搅拌后得无色透明溶液,没有CuSO4,Na2CO3或Na2SO4与CaCl2不同时存在;(2)往此溶液中滴加硝酸钡溶液,有白色沉淀生成,说明有Na2CO3或Na2SO4,或二者都有,则没有CaCl2;(3)过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解,沉淀是BaCO3,不含BaSO4,原混合物中有Na2CO3,没有Na2SO4。NaCl不能确定,可采用滤液中滴加AgNO3溶液方法来检验Cl-。
考点:通过实验判断混合物中的成分。

练习册系列答案
相关题目
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是
 |  |  | 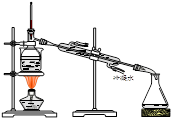 |
| A.海带灼烧成灰 | B.过滤得含I-溶液 | C.放出碘的苯溶液 | D.分离碘并回收苯 |
有一瓶无色气体,可能含有HCl、H2S、CO2、HBr、SO2中的一种或几种,将其通入氯水中得无色透明溶液,把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀,以下结论正确的是……( )
①原气体中肯定有SO2,②原气体中可能有SO2,③原气体中肯定没有H2S、HBr,④不能肯定原气体中是否含有HCl,⑤原气体中肯定无CO2,⑥原气体中肯定有HCl.
| A.①③④ | B.②④ | C.①③⑥ | D.①③⑤⑥ |
可以将六种无色液体:C2H5OH、AgNO3溶液,C2H5Br、KI溶液,C6H5OH溶液,C6H6区分开的试剂是
| A.FeCl3溶液 | B.稀硫酸 |
| C.酸性高锰酸钾溶液 | D.NaOH溶液 |
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、NO3-、SO42-、Cl-、I-、HCO3-,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有________,溶液中肯定存在的离子是____。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论)_____。
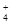 、SO
、SO 离子的实验方法正确的是________(填编号)。
离子的实验方法正确的是________(填编号)。
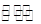 2RAn(有机层)+nH2SO4(水层),
2RAn(有机层)+nH2SO4(水层),