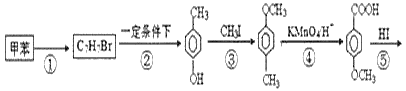
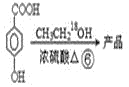
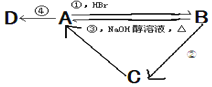
题目内容
【题目】以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。四种盐在不同温度下的溶解度表 (g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为________________;
②加料完毕,保温30分钟,目的_________;
③过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使_________________(填化学式)循环使用,回收得到NH4Cl晶体。
【答案】水浴加热 使反应充分进行 ![]()
【解析】
向饱和![]() 溶液加入
溶液加入![]() ,溶液中含有
,溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() ,可能相互结合生成四种物质
,可能相互结合生成四种物质![]() ,溶解度最小的会析出。
,溶解度最小的会析出。
① 反应需控制温度30-35℃,低于100℃,故可采用水浴加热方法;
答案为:水浴加热;
② 保温30分钟,目的是使该反应充分进行,
答案为:使反应充分进行;
③ 过滤所得母液中含有![]() ,可加入适量盐酸,碳酸氢钠和盐酸反应生成氯化钠,氯化钠可循环利用,同时还会生成氯化铵,回收利用;
,可加入适量盐酸,碳酸氢钠和盐酸反应生成氯化钠,氯化钠可循环利用,同时还会生成氯化铵,回收利用;
答案为:![]() 。
。

【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题
(1)表中元素原子半径最大的原子共占据的轨道数是_________个,Y最外层电子排布式为________,Z原子核外有_____种能量不同的电子。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
从原子结构的角度去解释Y元素的非金属性比S元素的非金属性强的原因:_______
(3)CO2的沸点_________CS2(填“>”或“<”或“=”),原因是_________________
(4)如果向BaCl2溶液中通入足量CO2气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用电离平衡移动原理解释上述现象。________
(5)过量的CO2通入NaOH溶液中,得到NaHCO3,在0.1mol/L的NaHCO3溶液中,c(Na+)+c(H+)=________其中有关碳微粒的关系为:___________ = 0.1mol/L。