题目内容
【题目】2018年4月23日,中国人民海军成立69周年。提到海军就不得不提航空母舰,我国正在建造第三艘航空母舰。镍铬钢抗腐蚀性能强,可用于建造航母。
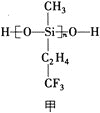
(1)航母甲板镍铬钢表面涂有一层耐高温的材料聚硅氧烷(结构如图甲所示)。基态Cr原子的价电子排布式为_____________,基态Si原子电子占据最高能级的电子云轮廓图为_____________形,元素C、O、F的电负性由大到小的顺序为_____________。
(2)海洋是元素的摇篮,海水中含有大量F、Cl、Br、I元素。
①OF2的空间构型为_____________,其中O原子杂化方式为_____________杂化。
②KCl晶体中存在的化学键类型有_____________;CaCl2熔点要比KCl的熔点高很多,主要原因为____________________________________________________________________。
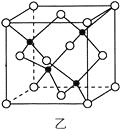
(3)海底金属软泥是在海洋底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、氧化铁、锰、锌等。Zn2+与S2-形成的一种晶胞结构如图乙所示(黑球表示Zn2+,白球表示S2-),Zn2+的配位数为_____________。晶胞边长为a nm、ZnS相对分子质量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____________g·cm-3。
【答案】3d54s1 哑铃 F>O>C V形 sp3 离子键 Ca2+半径比K+小,Ca2+所带电荷数比K+多,CaCl2的晶格能更高 4 ![]()
【解析】
(1)依据原子核外电子排布规则写出基态Cr原子的价电子排布式;依据Si的核外电子排布式可知其最高能级为3p能级,3p能级电子云轮廓图为哑铃形;根据C、O、F的非金属性推断其电负性;
(2)①OF2分子的中心原子为O原子,其中含有的孤电子对数为2,σ键数为2,价层电子对数为4,所以OF2的空间构型为V形,其中O原子的杂化方式为sp3杂化;②氯化钾为离子晶体,存在的化学键为离子键;钙离子的半径比钾离子小,钙离子所带电荷数比钾离子多,氯化钙的晶格能更高,所以氯化钙的熔点更高。
(3)通过硫化锌的晶胞结构分析锌离子的周围与之等距离的硫离子,即可知锌离子的配位数;通过硫化锌的晶胞结构可知锌离子的数目为4![]() 1=4,含有硫离子的数目为
1=4,含有硫离子的数目为![]() ,一个晶胞的体积为(a×10-7)3 cm3,由密度公式计算晶体的密度。
,一个晶胞的体积为(a×10-7)3 cm3,由密度公式计算晶体的密度。
(1)Cr为24号元素,核电荷数为24,故基态Cr原子的价电子排布式为3d54s1;Si元素为14号元素,核电荷数为14,核外电子排布式为1s22s22p63s23p2,最高能级为3p能级,3p能级电子云轮廓图为哑铃形;非金属性:F>O>C,则C、O、F的电负性由大到小的顺序为F>O>C。
(2)①OF2分子的中心原子为O原子,其中含有的孤电子对数为2,σ键数为2,价层电子对数为4,所以OF2的空间构型为V形,其中O原子的杂化方式为sp3杂化;②氯化钾为离子晶体,存在的化学键为离子键;钙离子的半径比钾离子小,钙离子所带电荷数比钾离子多,氯化钙的品格能更高,所以氯化钙的熔点更高。
(3)由硫化锌的晶胞结构可知,每个锌离子的周围与之等距离的硫离子有4个,所以锌离子的配位数为4;一个晶胞中含有锌离子的数目为4,含有硫离子的数目为4,一个晶胞的体积为(a×10-7)3 cm3,则晶体的密度为![]() 。
。

【题目】以前实验室制备纯碱(Na2CO3)的主要步骤为:将饱和NaCl溶液倒入烧杯加热,控制30—35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质、抽干,转入蒸发皿中灼烧得Na2CO3固体。四种盐在不同温度下的溶解度表 (g/100g水)
温度 溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | — | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①反应控制在30—35℃,是因为高于35℃NH4HCO3会分解,低于30℃则反应速率降低 ,为控制此温度范围,通常采取的加热方法为________________;
②加料完毕,保温30分钟,目的_________;
③过滤所得母液中含有NaHCO3、NaCl 、NH4Cl、NH4HCO3,加入适当试剂并作进一步处理,使_________________(填化学式)循环使用,回收得到NH4Cl晶体。
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿![]() 主要成分为ZnO,另含
主要成分为ZnO,另含![]() 、
、![]() 、CuO等
、CuO等![]() 生产
生产![]() 的一种流程如图:
的一种流程如图:
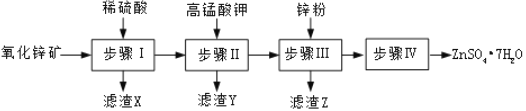
![]() 步骤Ⅰ的操作是______,滤渣A的主要成分是______。
步骤Ⅰ的操作是______,滤渣A的主要成分是______。
![]() 步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______。
步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______。
![]() 步骤Ⅱ中,在pH约为
步骤Ⅱ中,在pH约为![]() 的滤液中加入高锰酸钾,生成
的滤液中加入高锰酸钾,生成![]() 和
和![]() 两种沉淀,该反应的离子方程式为______。
两种沉淀,该反应的离子方程式为______。
![]() 步骤Ⅲ过滤后所得滤液中含有的金属阳离子有______。
步骤Ⅲ过滤后所得滤液中含有的金属阳离子有______。
![]() 已知硫酸锌的溶解度与温度之间的关系如下表:
已知硫酸锌的溶解度与温度之间的关系如下表:
温度 | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度 |
|
|
|
|
|
|
从硫酸锌溶液中获得硫酸锌晶体的实验操作为______、______、过滤。烘干操作需在减压低温条件下进行,原因是______。
![]() 取
取![]() g
g![]() 加热至不同温度,剩余固体的质最变化如图所示。
加热至不同温度,剩余固体的质最变化如图所示。

分析数据,![]() 时所得固体的化学式为______。
时所得固体的化学式为______。
![]()
![]()
![]()
![]()