题目内容
某温度时,在2L密闭容器中某一反应中A、B物质的量随时间变化的曲线如图所示:

由图中数据分析并填写空格:
(1)该反应的化学方程式为______________________________。
(2)在0~4min时间内,A的平均反应速率为__________________________。
(3)4 min时,正、逆反应速率的大小关系为: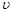 (正)_____________
(正)_____________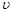 (逆)(填“>”、“<”或“=”,下同)8 min时
(逆)(填“>”、“<”或“=”,下同)8 min时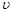 (正)_____________
(正)_____________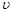 (逆)
(逆)

由图中数据分析并填写空格:
(1)该反应的化学方程式为______________________________。
(2)在0~4min时间内,A的平均反应速率为__________________________。
(3)4 min时,正、逆反应速率的大小关系为:
 (正)_____________
(正)_____________ (逆)(填“>”、“<”或“=”,下同)8 min时
(逆)(填“>”、“<”或“=”,下同)8 min时 (正)_____________
(正)_____________ (逆)
(逆)(1)3A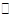 2B
2B
(2)0.05mol·L-1·min-1
(3) > =
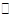 2B
2B(2)0.05mol·L-1·min-1
(3) > =
试题分析:(1)观察曲线可以发现,A是减少的,故为反应物,B是增加的,故为生成物。
xA
 yB,又整个过程,A的变化量为0.6mol,B的变化量为0.4mol,即A:B=3:2,故x=3,y=2,整个方程式为 3A
yB,又整个过程,A的变化量为0.6mol,B的变化量为0.4mol,即A:B=3:2,故x=3,y=2,整个方程式为 3A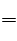 2B
2B(2) 平均速度=<(0.8-0.4)mol÷2L >÷4min=0.05mol·L-1·min-1
(3)4min时,A的物质的量还在继续减少,B的物质的量还在继续的增加,说明反应向正反应方向进行,故
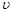 (正) >
(正) >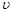 (逆),当t=8min时,A、B的物质的量都没有发生变化,说明反应达到平衡的状态,所以
(逆),当t=8min时,A、B的物质的量都没有发生变化,说明反应达到平衡的状态,所以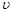 (正)=
(正)=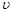 (逆)
(逆)点评:此题考核了学生对化学反应速率的相关知识,及对于可逆反应,在达到平衡前和平衡时的速度关系,难度不大。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则: 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是 B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B(g)+D(g)在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
 时间
时间 2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( )
2NH3已达平衡,如果保持其他条件不变,只增加N2的浓度,则 ( ) 2NO2(g),若N2O4的浓度由0.1 mol· L-1降到0.07 mol· L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需反应的时间( )
2NO2(g),若N2O4的浓度由0.1 mol· L-1降到0.07 mol· L-1需要15 s,那么N2O4的浓度由0.07 mol·L-1降到0.05 mol·L-1所需反应的时间( )