题目内容
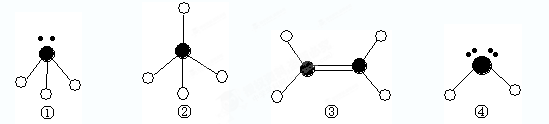
(10分)下列分子结构图中的 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
(1)以上分子中,中心原子采用sp2杂化的是 (填化学式);
(2)在③的分子中有 个σ键。在③与溴的四氯化碳溶液反应中,断裂的是③分子中的 键(填“σ”或“π”),形成的是 键(填“σ”或“π”)。
(3)4种分子中,属于极性分子的是 (填序号,下同)。键角由大到小的顺序是 ,能结合质子(即H+)形成稳定离子的是 ,形成 键(按电子对提供方式分类)。
(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为: ;
 表示氢原子,
表示氢原子, 表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
表示短周期的相邻的三种元素原子。小黑点表示没有形成共价键的最外层电子,短线表示共价键。
(1)以上分子中,中心原子采用sp2杂化的是 (填化学式);
(2)在③的分子中有 个σ键。在③与溴的四氯化碳溶液反应中,断裂的是③分子中的 键(填“σ”或“π”),形成的是 键(填“σ”或“π”)。
(3)4种分子中,属于极性分子的是 (填序号,下同)。键角由大到小的顺序是 ,能结合质子(即H+)形成稳定离子的是 ,形成 键(按电子对提供方式分类)。
(4)已知液态①和④相似,也可发生微弱的电离,电离出含有相同电子数的微粒,则①的电离方程式为: ;
(10分,最后一空2分,其余1分)(1)C2H4 (2)5、π、σ
(3)①④,③②①④,①④,配位 (4)2NH3 NH4++NH2-
NH4++NH2-
(3)①④,③②①④,①④,配位 (4)2NH3
 NH4++NH2-
NH4++NH2-根据分子的结构可知,①②③④分别是氨气、甲烷、乙烯、水。
(1)乙烯是平面型结构,则中心原子碳原子采用sp2杂化。
(2)单键都是σ键,而双键是由1个σ键和1个π键形成的,所以乙烯分子中含有5个σ键。乙烯和溴水发生加成反应,π键不稳定,断裂的是π键,形成单键,乙醇形成的是σ键。
(3)氨气和水属于极性分子。四种分子的键角分别是107°、109°28〞、120°、105°,所以顺序是③②①④。氨气、水易结合氢离子形成配位键。
(4)根据水的电离方程式可写出氨气的电离方程式,即2NH3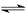 NH4++NH2-。
NH4++NH2-。
(1)乙烯是平面型结构,则中心原子碳原子采用sp2杂化。
(2)单键都是σ键,而双键是由1个σ键和1个π键形成的,所以乙烯分子中含有5个σ键。乙烯和溴水发生加成反应,π键不稳定,断裂的是π键,形成单键,乙醇形成的是σ键。
(3)氨气和水属于极性分子。四种分子的键角分别是107°、109°28〞、120°、105°,所以顺序是③②①④。氨气、水易结合氢离子形成配位键。
(4)根据水的电离方程式可写出氨气的电离方程式,即2NH3
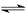 NH4++NH2-。
NH4++NH2-。
练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
 Cl ③白磷 ④氯气 ⑤红磷 ⑥
Cl ③白磷 ④氯气 ⑤红磷 ⑥ Cl
Cl 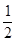 O2(g)=H2O(g) △H1=a kJ·mol-1
O2(g)=H2O(g) △H1=a kJ·mol-1