题目内容
【题目】掺杂硒的纳米氧化亚铜常用作光敏材料、能源行业催化剂等。
(1)酸性溶液中Na2SO3将H2SeO3和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)===Se(s)+2H2 SO4(aq) △H1
2H2SeO4(aq)+Se(s)+ H2O (1)===3H2SeO3(ag) △H2
H2SeO4(aq)+ 3SO2(g)+2H2 O(1)===Se(s)+3H2 SO4 (aq) △H3
则△H2=___________(用△H1和△H3表示)。
(2)H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS),羰基硫的结构式为______________________。
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示。
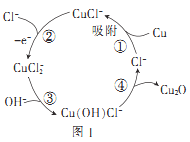
①阳极的电极反应式为_________________________________。
②电解一段时间后,向电解液中补充一定量的_______________可将溶液恢复至初始状态。
(4)掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。
按![]() 的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。
的投料比将H2与CO充人VL的恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化率与温度、压强的关系如图2所示。

①a___________(填“>”或”<”)0;压强p1、p2、p 3由小到大的顺序是___________。
②T1℃时,若向该容器中充入2.0mol H2和2.0 mol CO发生上述反应,5min后反应达到平衡(M点),则0~5min内,v(H2)=___________mol·L-1·min-1,N点对应条件下反应的平衡常数为___________。
【答案】2△H3-3△H1 O=C=S CuCl--e-+Cl-=CuCl2- H2O(或“水”) < p3<p2<p1 ![]() 4.17V2
4.17V2
【解析】
(1)根据盖斯定律,将反应III×2-I×3即可得到反应II;
(2)COS与CO2是等电子体,结构相同,羰基硫的结构式为O=C=S;
(3)①用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液得到氧化亚铜,阳极的电极反应:CuCl—e-+Cl-=CuCl2-,
②综合反应过程分析,实质是铜和水反应生成氧化亚铜和氢气,减少的是水,
(4)①由图可知,压强一定时,温度升高,CO的转化率降低,说明正反应为放热反应,△H<0;温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应是气体体积减小的反应,增大压强平衡向正反应进行,CO的转化率升高,故压强p1>p2>p3,
②由图可知,5min后反应达到平衡(M点),CO的转化率为40%,列出三段式,找出平衡时各物质的浓度及转化浓度,根据![]() =
=![]() 计算速率;
计算速率;
平衡常数只与温度有关,N点与M点温度相同,N点对应条件下反应的平衡常数与M点相同。
(1)已知:I、H2SeO3(aq)+2SO2(g)+H2O(l)===Se(s)+2H2 SO4(aq) △H1
II、2H2SeO4(aq)+Se(s)+ H2O (1)===3H2SeO3(ag) △H2
III、H2SeO4(aq)+ 3SO2(g)+2H2 O(1)===Se(s)+3H2 SO4 (aq) △H3
将反应III×2-I×3即可得到反应II,则反应II的反应热△H2=2△H3-3△H1;
故答案为:2△H3-3△H1;
(2)COS与CO2是等电子体,结构相同,羰基硫的结构式为O=C=S;
故答案为:O=C=S;
(3)①用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液得到氧化亚铜,阳极的电极反应:CuCl--e-+Cl-=CuCl2-,
故答案为:CuCl--e-+Cl-=CuCl2-;
②综合反应过程分析,实质是铜和水反应生成氧化亚铜和氢气,减少的是水,
故答案为:水。
(4)①由图可知,压强一定时,温度升高,CO的转化率降低,说明正反应为放热反应,△H<0;温度一定时,CO的转化率α(P3)<α(P2)<α(P1),该正反应是气体体积减小的反应,增大压强平衡向正反应进行,CO的转化率升高,故压强p1>p2>p3,
故答案为:<;p3<p2<p1;
②由图可知,5min后反应达到平衡(M点),CO的转化率为40%,
CO(g) + 2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 2mol 2mol 0
变化(mol)0.8mol 1.6mol 0.8mol
平衡(mol)1.2mol 0.4mol 0.8mol
则v(H2)=![]() =
=![]() mol·L-1·min-1;
mol·L-1·min-1;
因平衡常数只与温度有关,而N点与M点温度相同,所以N点对应条件下反应的平衡常数与M点相同:K=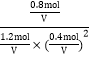 =4.17V2
=4.17V2
故答案为:![]() ;4.17V2。
;4.17V2。

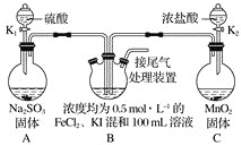
【题目】化学课上,同学们利用下列实验探究碱的化学性质:
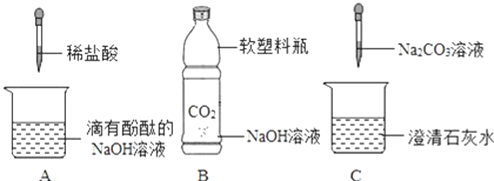
(1)A实验中观察到的现象是_______。
(2)B实验中发生的离子反应方程式是_____。
(3)C实验中发生的离子反应方程式是____。
(4)实验结束后,同学们将废液倒入同一只废液缸中,最后发现废液浑浊并显红色。
(提出问题)废液中含有什么物质?
(假设猜想)通过分析,同学们猜想:废液中除酚酞、碳酸钙及水以外一定含有_____。
老师问:废液中还可能有什么物质?引发了同学们热烈讨论,下面是大家的发言:
学生甲 | 可能有CaCl2、Na2CO3 | 学生丙 | 可能有Ca(OH)2、CaCl2 |
学生乙 | 可能有NaOH、Na2CO3 | 学生丁 | 可能有Na2CO3 |
学生戊 | 可能有NaOH | … | … |
上述几位学生的猜想中,有一种明显不合理,你认为谁的猜想不合理?并说明理由。_____
(实验验证)同学们对可能含有的物质进行确定,取一定量的废液过滤,向滤液中逐滴加入氯化钡溶液,得到白色沉淀,红色褪去。
(结论)上述废液中,还含有____,没有_____。