��Ŀ����
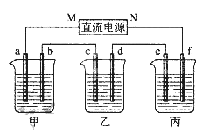
����Ŀ����ͼ��ʾ���ף������������У��ֱ����0.1mol/L��NaCl��Һ��0.1mol/L��AgNO3��Һ����PtΪ�缫���е��ʱ������˵������ȷ���ǣ� ��
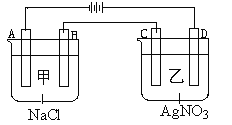
A. �������ձ�����Һ��pH������
B. ��A��B��C��D���缫������������ʵ���֮��Ϊ��2:2:4:1
C. �������У�A�缫�Ϸ�����ԭ��Ӧ��2Cl--2e-=Cl2
D. ��������Һ�м�������AgNO3���壬��ʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH
���𰸡�B
��������A. ����Ȼ�����Һ�����������ƣ�������Һ��pH�������������Һ�������ᣬ������Һ��pH��С����A����B.����ͼʾ���õ�A���������õ缫���������ӵõ��ӣ�2H++2e-=H2����B���������õ缫����������ʧ���ӣ��缫��ӦΪ2Cl--2e-=Cl2����C���������õ缫����������������Ag++e-=Ag��D���������õ缫�ϲ���������4OH--4e-=O2��+2H2O�������缫��ת�Ƶ��ӵ����ʵ�������ȵģ���ת�Ƶ���1mol��������A��B��C��D���缫�����ɵ����ʵ���֮��Ϊ0.5��0.5��1��0.25=2��2��4��1����B��ȷ��C. A���������õ缫���������ӵõ��ӣ�2H++2e-=H2������C����D. ���AgNO3��Һ���ܷ�ӦΪ4AgNO3 + 2H2O ![]() 4Ag��+ O2��+ 4HNO3��Ҫʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH����������������ﲻ��Ҫ��Ӧ�ü������������壬��D����ѡB��
4Ag��+ O2��+ 4HNO3��Ҫʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH����������������ﲻ��Ҫ��Ӧ�ü������������壬��D����ѡB��

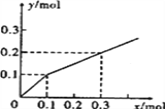
����Ŀ����֪�ϳɰ���Ӧ��Ũ���������£����ð���Ũ�ȵ���������ʾ�û�ѧ��Ӧ����ʱ��������Ϊ�� ��
N2+3H22NH3 | |||
��ʼŨ��mol/L | 1.0 | 3.0 | 0 |
2��ĩŨ��mol/L | 0.6 | 1.8 | a |
A. 0.2mol/��Ls�� B. 0.4mol/��Ls�� C. 0.6mol/��Ls�� D. 0.8mol/��Ls��