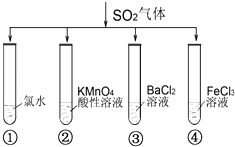
题目内容
【题目】2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2=2CO2 +3H2O,电池示意图如下,下列说法中正确的是
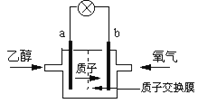
A.b极为电池的负极
B.电池工作时电子在内电路中由a极经溶液到b极
C.电池负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+
D.电池工作时,1mol乙醇被氧化时有6mol电子转移
【答案】C
【解析】
试题分析:A.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故A错误;B.电池工作时,电子在外电路中由a极经溶液到b极,内电路中是电解质溶液中的阴阳离子定向移动,故B错误;C.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,燃料乙醇在负极发生失电子的氧化反应,负极的电极反应为:C2H5OH+3H2O-12e-=2CO2+12H+,故C正确;D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,则1mol乙醇被氧化失去12mol电子,所以1mol乙醇被氧化电路中转移12NA的电子,故D错误;答案为C。

练习册系列答案
相关题目