题目内容
【题目】化学上常用燃烧法确定有机物组成,这种方法是在电炉加热时用纯氧气氧化管内样品,根据产物的质量确定有机物的组成。下列装置是用燃烧法确定有机物分子式常用的装置。
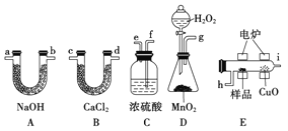
(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是 。
(2)C装置中浓硫酸的作用是 。
(3)D装置中MnO2的作用是 。
(4)燃烧管中CuO的作用是 。
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92 g样品,经充分反应后,A管质量增加1.76 g,B管质量增加1.08 g,则该样品的实验式为 。
(6)用质谱仪测定其相对分子质量,得如图一所示的质谱图,则该有机物的相对分子质量为 。

(7)能否根据A的实验式确定A的分子式 (填“能”或“不能”),若能,则A的分子式是 (若不能,则此空不填)。
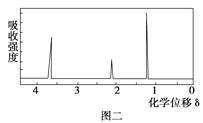
(8)该物质的核磁共振氢谱如图二所示,则其结构简式为 。
【答案】
(1)g→f,e→h,i→c,d (或d,c)→a ,b (或b,a)
(2)吸水,干燥O2
(3)催化剂,加快O2的生成
(4)使有机物充分氧化生成CO2和H2O
(5)C2H6O (6)46 (7)能 C2H6O (8)CH3CH2OH
【解析】
试题分析:据实验目的和各装置的作用推知整套装置为产生氧气→干燥氧气→有机物燃烧→B测定水的质量→测定二氧化碳质量,即D→C→E→B→A,各导管接口顺序为g→f,e→h,i→c,d→a,干燥管的两端可以颠倒,其中D为O2发生装置(MnO2作催化剂),C中浓H2SO4作用是吸收水分,得到干燥纯净的O2,E为有机物燃烧装置,B中CaCl2吸收反应生成的H2O,A中NaOH吸收反应生成的CO2,m(CO2)=1.76g g,n(CO2)=0.04 mol,m(H2O)=1.08 g,则n(H2O)=0.06 mol,则m(C)+m(H)=12×0.04+0.06×2=0.6g<0.92g,所以有机物中含有氧元素,质量是0.32g,即0.02mol,所以该有机物的最简式为C:H:O=0.04:(0.06×2):0.02=2:6:1,即C2H6O.
(1)产生氧气中含有水,应经过干燥后才可与有机物反应,生成二氧化碳和水,用无水氯化钙吸收水,用碱石灰吸水二氧化碳,整套装置为D→C→E→B→A,干燥管的两端可以颠倒,各导管接口顺序为g、f、e、h、i、c(或d)、d(或c)、a(或b)、b(或a)。(2)C中浓H2SO4作用是吸收水分,得到干燥纯净的O2。(3)D为O2发生装置,双氧水在二氧化锰作催化剂条件下反应生成氧气(4)燃烧管中CuO为有机物完全燃烧转化为二氧化碳和水起到了作用。(5)由以上分析可知该有机物的最简式为C2H6O,故答案为:C2H6O;(6)根据质谱法分析,相对分子质量为46。(7)因最简式中氢原子数达饱和,故其分子式为C2H6O,故答案为:能,C2H6O。(8)根据核磁共振氢谱分析,含有3组峰,面积比为1:2:3,所以其结构为CH3CH2OH。