题目内容
【题目】如图是实验室制备气体和验证气体性质的装置图,若利用该装置实现碳和浓硫酸的反应,并进行如下验证:
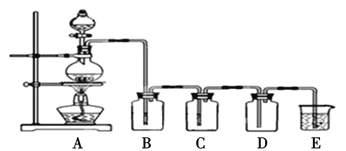
(1)实验步骤: 连接仪器、____、加药品后,然后滴入浓硫酸,加热。
(2)C与浓硫酸反应的化学方程式是____。
(3)若要证明产物中的两种气体,装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B、D装置中品红溶液的作用分别是____,____。证明气体中有CO2的现象是____。
(4)若证明SO2具有氧化性,同时证明碳的非金属性比硅强,B、C、D中分别装有Na2S溶液、足量酸性KMnO4溶液、品红溶液。则:B中的现象为____;E中应加入____溶液(填化学式),现象为____,反应的离子方程式为____。
【答案】 检查装置气密性 C+2H2SO4(浓) ![]() CO2↑+SO2↑+2H2O 检验SO2 检验SO2是否除尽 D中品红褪色,E中澄清石灰水变浑浊。 产生淡黄色沉淀 Na2SiO3 产生白色沉淀 SiO32-+CO2+H2O=H2SiO3↓+CO32-
CO2↑+SO2↑+2H2O 检验SO2 检验SO2是否除尽 D中品红褪色,E中澄清石灰水变浑浊。 产生淡黄色沉淀 Na2SiO3 产生白色沉淀 SiO32-+CO2+H2O=H2SiO3↓+CO32-
【解析】(1)通常连接仪器后,需要先检验装置气密性,后再装药品;
(2)C与浓硫酸反应生成CO2和SO2的化学方程式是C+2H2SO4(浓) ![]() CO2↑+SO2↑+2H2O;
CO2↑+SO2↑+2H2O;
(3)装置B、C、D、E中分别装有品红溶液、酸性KMnO4溶液、品红溶液、澄清石灰水,则B装置中品红溶液的作用是检验SO2,D装置中品红溶液的作用是验证二氧化硫是否被高锰酸钾溶液完全吸收,证明气体中有CO2的现象是D装置中品红不退色,E装置中有白色沉淀;
(4)若证明SO2具有氧化性,通过装置B中的Na2S溶液验证,二氧化硫和硫化钠反应生成硫单质,溶液中变浑浊,证明碳酸的酸性比硅酸的强,是通过高锰酸钾溶液除去二氧化硫后,再通过品红溶液检验二氧化硫是否除净,把气体通过硅酸钠溶液生成白色沉淀证明碳酸的酸性比硅酸的强,发生反应的化学方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-。

【题目】提纯下列物质(括号内物质为杂质),选用的试剂和方法都正确的是( )
物 质 | 除杂试剂 | 方法 | |
A | CO( CO2) | NaOH溶液 | 洗气 |
B | FeCl2溶液( FeCl3) | 足量铜粉 | 过滤 |
C | KNO3(KCl) | ﹣﹣ | 蒸发结晶 |
D | Al2O3(Fe2O3) | NaOH溶液 | 过滤 |
A.A
B.B
C.C
D.D
【题目】四种易溶于水的强电解质A、B、C、D由以下7种离子组成(电解质中阴离子各不相同)。
阴离子 | Na+ Ba2+ NH4+ |
阳离子 | CH3COO- Cl- OH- SO42- |
已知:①A、C溶液显碱性,A、B的溶液中水的电离程度相同;②C和D的溶液混合反应的现象只是有白色沉淀生成,B和C的溶液混合反应的现象只是有刺激性气味的气体生成,A和D的溶液混合无明显现象。
(1)A是__________,B是_____________。
(2)写出C与D的溶液反应的离子方程式_______________________。
(3)25℃时,0.1mol/LB溶液的pH=a,则B溶液中c(H+)—c(NH3·H2O)=_______________(用含有a的关系式表示)。
(4)将等体积、等物质的量浓度的B溶液和C溶液混合反应后溶液中各种离子浓度由大到小的顺序是______________________。
(5)向用盐酸中和后的C溶液中加入AgNO3和KBr,当两种沉淀共存时,c(Br—)/c(Cl—) =_________。(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)