题目内容
【题目】某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题(Cl2易溶于CCl4)。
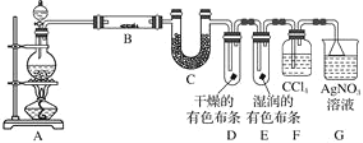
(1)若用含有7.3 g HCl的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2质量总是小于3.55 g的原因是________________________________。
(2)①装置B中盛放的试剂名称为________________,作用是________________________________,现象是_____________________________。
②装置D和E中出现的不同现象说明的问题是___________________。
③装置F的作用是__________________________________________。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在________与________之间(填装置字母序号),装置中应放入________(填写试剂或用品名称)。
【答案】浓盐酸的浓度随着反应的进行逐渐变稀,变为稀盐酸以后将不再与MnO2反应;加热时浓盐酸因挥发而损失 无水硫酸铜 证明有水蒸气产生 白色固体变蓝色 氯气无漂白性,次氯酸有漂白性 吸收氯气 F G 湿润的淀粉-KI试纸(或湿润的有色布条)
【解析】
加热条件下浓盐酸和二氧化锰发生氧化还原反应生成氯气,生成的氯气中含有氯化氢和水,B为硫酸铜,可用于检验水,C为氯化钙,可用于吸收水,D中干燥的有色布条不褪色,E中湿润的有色布条可褪色,F用于吸收氯气,G可用于检验氯化氢,溶液变浑浊,生成氯化银沉淀,据此解答该题。
(1)浓盐酸与足量MnO2反应制取Cl2,反应需要加热,盐酸易挥发,反应消耗氯化氢,随反应的不断进行浓盐酸的浓度逐渐变稀,稀盐酸不与MnO2反应,故答案为:浓盐酸的浓度随着反应的进行逐渐变稀,变为稀盐酸以后将不再与MnO2反应;加热时浓盐酸因挥发而损失;
(2)①无水硫酸铜与水反应生成蓝色五水硫酸铜晶体,可用来检验水,故答案为:无水硫酸铜;证明有水蒸气产生;白色固体变蓝色;
②D中干燥的布条不褪色,E中湿润的布条褪色说明干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性,故答案为:氯气无漂白性,次氯酸有漂白性;
③氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰氯气中含有的氯化氢的检验,故答案为:吸收氯气;
(3)氯气、氯化氢通入到硝酸银都会产生沉淀,为了确保实验结论的可靠性,应在装置F和G之间增加一个盛有湿润的淀粉—碘化钾试纸或者湿润的有色布条的广口瓶,如果湿润的淀粉—碘化钾试纸不变蓝或者湿润的有色布条不褪色,则氯气被完全吸收,故答案为:F;G;湿润的淀粉—KI试纸(或湿润的有色布条)。

【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181kJ·mol-1
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:_____;下列措施能够增大此反应中NO的转化率的是(填字母代号)______。
,请写出此反应的热化学方程式:_____;下列措施能够增大此反应中NO的转化率的是(填字母代号)______。
A.增大容器压强B.升高温度C.使用优质催化剂D.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①05min内,以CO2表示的该反应速率v(CO2)=_______,该条件下的平衡常数K=_____。
②第15min后,温度调整到T2,数据变化如上表所示,则T1____T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,则此时反应_____移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=____________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
【题目】工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
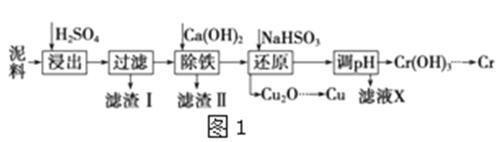
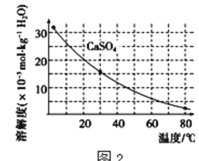
已知部分物质沉淀的pH及CaSO4的溶解度曲线如图2:
Fe3+ | Cu2+ | Cr3+ | |
开始沉淀pH | 2.1 | 4.7 | 4.3 |
完全沉淀pH | 3.2 | 6.7 | a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有__;
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到约__,检验Fe3+已经除尽的操作是__;②将浊液加到80℃,__;
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式__,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是__;
(4)在FeS饱和溶液中存在:FeS(s)![]() Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。
Fe2+(aq)+S2-(aq),常温下FeS的Ksp=6.25×10-18。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:c2(H+)c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1molL-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)为___。