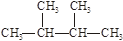题目内容
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
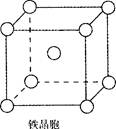
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。
该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
⑴V形 ⑵两种化合物均为原子晶体,Si—O键键能大于Si—N键
⑶sp3 ⑷CrO2 ⑸①3d3 ②6NA(每空2分,共12分)
解析试题分析:根据信息确定A为氮元素、B为氧元素、C为硅元素、D为铬元素。
⑴NO2-中心原子形成2个σ键,孤对电子对数=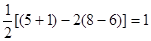 ,故其空间构型为V型或角型。
,故其空间构型为V型或角型。
⑵N、O分别与Si形成的化合物均为原子晶体,由于Si—O键键能大于Si—N键,故O、Si形成的化合物熔点较高。
⑶在N2H4中,每个氮原子除了形成3个σ键外还有1个孤对电子,故N原子轨道的杂化类型为sp3。
⑷在该晶胞中含有Cr原子数: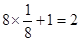 个,含有O原子数:
个,含有O原子数: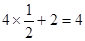 个,则该化合物的化学式为CrO2。
个,则该化合物的化学式为CrO2。
⑸①Cr的基态电子排布式为[Ar]3d54s1,则Cr3+的外围电子排布式为3d3。
②该配合物分子中所含配位键数目为3+1+2=6个,则1 mol该配合物中含配位键的数目为6NA。
考点:考查物质结构与性质(微粒的空间构型、晶体熔沸点比较、中心原子的杂化类型、晶胞化学式的计算、外围电子排布式的书写、配位键等)。




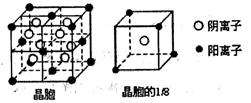


 图2
图2 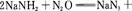
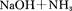
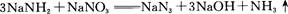 回答下列问题:
回答下列问题:
 ③白磷 ④18O ⑤
③白磷 ④18O ⑤