题目内容
(12分,每空2分)氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:
(1)Na3N的电子式是_______;该化合物是由______键形成的_____(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
(1)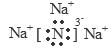 ;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<
;离子 离子;(2) 两 Na3N+4HCl==3NaCl+NH4Cl; (3)<
解析试题分析:(1)Na3N是离子化合物;在Na与N原子之间通过离子键结合。Na3N的电子式是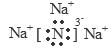 。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
。(2)Na3N与盐酸反应的方程式Na3N+4HCl=3NaCl+ NH4Cl.因此生成2种盐。(3)Na+、N3-的核外都是2、8的电子层结构。对于电子层结构相同的微粒来说,核电荷数越大,离子的半径就越小。因此在Na3N中两种微粒的半径:r(Na+)<r(N3-)。
考点:考查电子式、化学方程式的书写、离子半径的比较、物质内的化学键及晶体结构的知识。

(15分)X、Y、Z、W、R、T为前四周期元素且原子序数依次增大。T原子序数等于X、Y、R原子序数之和。Z为地壳中含量最多的元素。X、Z原子核外均有2个未成对电子。Z与R位于同一主族。X、Y、Z、W、R、T中只有两种金属元素,且存在下列反应: 2W+XZ2 X+2WZ
X+2WZ
回答下列问题:
(1)X、Y、Z的第一电离能最大的是 (用元素符号表示)。
(2)在元素R和元素Z形成的常见化合物中,属于非极性分子的是 (填化学式),该分子中中心原子以 杂化。
(3)由X、T元素组成的单质中一定不存在 (填序号)。
| A.离子晶体 | B.分子晶体 | C.原子晶体 | D.金属晶体 |
(5)T+能与NH3通过配位键结合为[T(NH3)n]+。该离子中T+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对。① [T(NH3)n]+中n= 。② [T(NH3)n]+中T+与n个氮原子构成的空间结构呈 型。
(6)化合物WZ和NaCl的晶胞结构形似
(氯化钠晶胞结构如右图所示)。

①在WZ中,阳离子和阴离子的配位数均为 。
②已知WZ的密度为a g/cm3,则WZ中距离最近的阳离子间的距离为 pm(用含a的算式表示,阿伏伽德罗常数为NA)。
(12分) 类推法是科学学习的重要方法之一
⑴下列类推结论正确的是
| | 类比对象 | 结论 |
| A | Cl2+H2O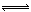 HCl+HClO HCl+HClO | I2+H2O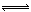 HI+HIO HI+HIO |
| B | C+2CuO ="==" 2Cu+CO2↑(条件:加热) | C+SiO2 ="==" Si+ CO2↑(条件:加热) |
| C | Na2O+H2O ="=" 2NaOH | CuO+H2O ="=" Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O="=" CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O="=" CaSO3↓+2HClO |
| 元素 | 8O | 16S | 34Se | 52Te |
| 单质熔点(℃) | -218.4 | 113 | | 450 |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径 | 逐渐增大 | |||
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
② 碲的化合价可能的范围_______ ;
③ 硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是 (填化学式);
④ 氢硒酸有较强的________(填“氧化性”或“还原性”),因此放在空气中长期保存易变质,其可能发生的化学方程式为___________________________________。
(14分)A、B、C、D为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如下表所述。
| 元素 | A | B | C | D |
| 性质 结构 信息 | 工业上常用电解熔融AD2制取A的单质。 | B的最外层电子数比最内层电子数多1。 | C的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂。 | D的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强。 |
(1)工业上制取A的单质的化学方程式: 。
(2)在25oC、10l kPa下,已知13.5g的B的固体单质在D的气体单质中完全燃烧后恢复至原状态,放热419 kJ,该反应的热化学方程式是 。
(3)Sn与元素C同主族,周期数比元素C的大2.则Sn的原子序数为 ;配制SnCl2溶液时需用盐酸溶解其晶体,其目的是 。
(4)甲中各原子都满足8电子稳定结构,其电子式为 ;甲溶于水后光照一段时间溶液酸性增强的原因(用离子方程式表示) 。
(5)将A的单质、B的单质棒用导线连接后插入稀NaOH溶液中。写出负极反应的电极方程式 。
A~E五种元素中,除E外均为短周期元素,且原子序数依次增大。它们的原子
结构或性质如下表所示:
| 元素 | A | B | C | D | E |
| 结构或性质 | 原子半径最小的元素 | 地壳中含量最多的元素 | 可与B形成阴阳离子个数比为1:2的两种化合物 | 与B同主族 | 单质是生活中最常见的金属,可被磁铁吸引 |
(1)元素D在周期表中的位置为 。
(2)C与B形成原子个数比为1∶1的化合物中,含有的化学键类型为 。
(3)化合物甲、乙是由A、B、C、D四种元素中的三种组成的强电解质,且两种物质水溶液均显碱性。若甲能抑制水的电离,乙能促进水的电离,则化合物甲的电子式为 ;乙的化学式是 。
(4)以E构成的单质为Y极,碳棒为X极,在6 mol/L的NaOH溶液中进行电解,制取高效净水剂Na2YO4(溶液呈紫红色)。其装置如图。电解过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色,且Y电极变细;电解液澄清。Y极发生的电极反应为:4OH--4e-
 2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。
2H2O+O2↑和 。若在X极收集气体672 mL,在Y极收集气体168 mL(均已折算为标况下体积),则Y电极质量减少 g。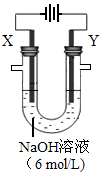
(5)Se是人体必备的微量元素,与B、D同一主族。Se的原子序数为34,且B、D、Se元素气态单质分别与H2反应生成1 mol气态氢化物的反应热如下:
a.+ 29.7 kJ/mol b.-20.6 kJ/mol c.-241.8 kJ/mol
表示生成1 mol H2Se的反应热是 (填序号);依据是: 。

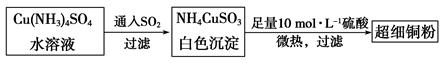
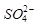 的空间构型为_____________,
的空间构型为_____________,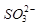 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。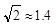 ,列式并计算结果)。
,列式并计算结果)。