题目内容
【题目】我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,某实验小组拟提取靑蒿素并测定其化学式。
【査阅资料】青蒿素为无色针状晶体,熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
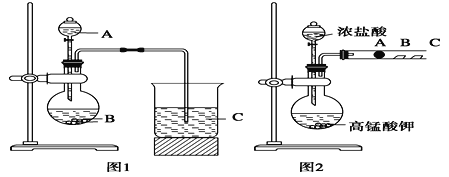
I.实验室用乙醚提取靑萵素的工艺流程如下图:
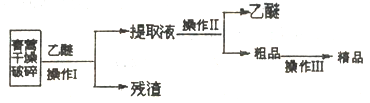
(1)在操作I前要对青蒿进行粉碎,其目的是____________。
(2)操作II的名称是_______________。
(3)操作III进行的是重结晶,其操作步骤为加热溶解→______→_______→过滤、洗涤、干燥。
II.己知青蒿素是一种烃的含氧衍生物,为确定其化学式,又进行了如下实验:
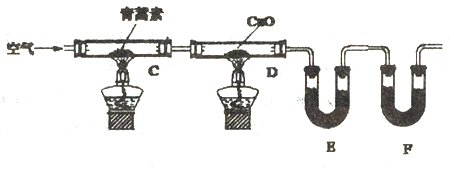
实验步骤
①连接装置,检査装置的气密性。
②称量E、F中仪器及药品的质量
③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量
(4)装置E、F应分别装入的药品为______、_________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100. 00g | 133.00g |
通过质谱法测得靑蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
(6)有同学认为使用上述方法会产生较大实验误差,你的改进方法是_______________。
【答案】 增大靑蒿与乙醚的接触面积,提高浸出效率 蒸馏 趁热过滤 冷却结晶 无水氯化钙(五氧化二磷、硅胶) 碱石灰 C15H22O5 在左侧增加除去空气中二氧化碳、水蒸气的除杂装罝,冋时在右侧增加防止空气中二氧化碳、水蒸气进入装罝F的装罝
【解析】(1)根据乙醚浸取法的流程可知,操作I前对青蒿进行干燥破碎,可以增大青蒿与乙醚的接触面积,提高青蒿素的浸取率;
(2)提取液经过蒸馏后可得青蒿素的粗品;
(3)重结晶的步骤为加热溶解、趁热过滤、冷却结晶、过滤、洗涤、干燥;
(4)E和F一个吸收生成的H2O,一个吸收生成的CO2,应先吸水后再吸收CO2,所以E内装的无水CaCl2或硅胶或P2O5,而F中为碱石灰;
(5)由数据可知m(H2o)=33.9g-24g=9.9g,所以n(H2o)=0.55mol
m(co2)=133g-100g=33g,所以n(co2)=0.75mol,所以青蒿素中氧原子的质量为m(o)=14.1g-(1.1×1)-(0.75×12)=4g,所以n(o)=0.25mol,N(C):N(H):N(o)=0.75:1.1:0.25=15:22:5,所以为C15H22O5;
(6)需准确测量青蒿素燃烧生成的CO2和H2O,实验前应排除装置内的空气,防止干扰实验,故应在左侧增加除去空气中二氧化碳、水蒸气的除杂装,同时在右侧增加防止空气中二氧化碳、水蒸气进入装置F的装置。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案【题目】己知A、B、C、D、E、F、G都是周期表中前四周期的元素,他们的原子序数依次增大。其中A原子的L层有2个未成对电子。D是电负性最大的元素,E与F同主族,E的二价阳离子与C的阴离子具有相同的电子层结构。G3+离子3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
⑴A、B、C的第一电离能由小到大的順序为_____________。D的核外有____种运动状态不同的电子。
⑵A的最简单氢化物属于______(填“极性分子”和“非极性分子”)。AH3+离子空间构型是________,其中心原子采取______杂化。
⑶G和M (质子数为25)两元素的部分电离能数据列于下表:
元素 | M | G | |
电离能 (kJmol-1) | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态G2+再失去一个电子难。其原因是____________;
⑷晶体熔点:EC____FC (填“ > ”、“<”或“=”),原因是_______________。
(5)H2S和C元素的一种氢化物(分子式为H2C2)的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
h2s | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
h2s和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因___________。
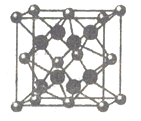
(6)FD2晶胞如图,已知DF核间距为a pm,则该晶体密度ρ=______g㎝-3(用带a、NA的算式表示,不必化简)