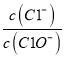题目内容
【题目】某研究性学习小组设计了一组实验验证元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成元素氮、碳、硅非金属性强弱比较的实验研究。已知A是强酸,B是块状固体;打开分液漏斗的活塞后,可看到有大量气泡产生;烧杯中可观察到白色沉淀生成。
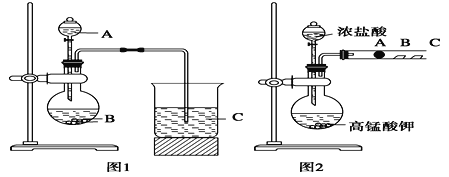
(1)写出选用的物质:A_________,B_________,C_________(填化学式);
(2)乙同学认为甲同学设计的实验不够严谨,应该在B和C之间增加一个洗气装置,该装置中应盛放___________。(填试剂)
(3)烧杯中反应的离子方程式为___________________________________。
(4)丙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr 溶液的棉花、湿润淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。A处的实验现象为:_____________;写出B处反应的离子方程式___________。
(5)丙同学的实验不能充分证明氧化性:Cl2>Br2>I2,理由是______________________。
【答案】 HNO3 CaCO3 Na2SiO3 饱和NaHCO3溶液 CO2 + SiO32― + H2O = H2SiO3↓+ CO32―或2CO2 + SiO32―+ 2H2O = H2SiO3↓+ 2HCO3― 棉花由白色变为橙黄色 2I-+Cl2=2Cl-+I2 不能验证Br2和I2的氧化性强弱 (前两问每空一分,后三问每空两分)
【解析】(1)依据强酸制弱酸来设计反应,所以A为硝酸,B为碳酸钙,C为硅酸钠溶液;
(2)硝酸易挥发,避免干扰,所以为吸收挥发出来的硝酸,应在B和C之间增加一个洗气装置盛放饱和的碳酸氢钠;
(3)图1烧杯中为二氧化碳与硅酸钠反应生成硅酸沉淀和碳酸钠,其反应的离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(4)NaBr溶液的棉花与氯气反应生成单质溴,所以棉花由白色变为橙黄色,B处湿润淀粉KI试纸中的碘离子与氯气反应生成单质碘,反应的离子方程式为:2I-+Cl2=2Cl-+I2;向NaBr和KI的混合溶液中,通入足量的Cl2充分反应后,将所得溶液蒸干并灼烧,过量的氯气逸出,溴挥发,碘升华,所以最后得到NaCl和KCl;
(5)反应中只能证明氯气比Br2和I2的氧化性强,但不能验证Br2和I2的氧化性强弱.

【题目】甲醇、乙醇是生活中常见且用途广泛的物质,其合成方法和性质均具有研究价值。
(1)已知下表中键能数据,则气态乙醇完全燃烧生成CO2和水蒸气的热化学方程式为__________。
化学键 | C-C | C-H | O-O | H-O | C-O | C-O |
键能/(kJ·mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
(2)向一容积可变的密闭容器中充入1mol CO与2 molH2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
CH3OH(g) △H1<0。CO在不同温度下的平衡转化率(a)与压强的关系如图所示。
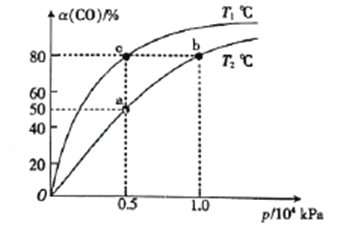
①a、b两点的反位速率:v(b)_____v(a)(填“>”“<”或“=”,下同)。
②T1____T2。
③该合成反应的温度一般控制在240~270℃,选择此范围的原因:此温度范围下的催化剂活性高;__________________________。
④图中a、b、c三点对应的化学平衡常教K(a)、K(b)、K(c)的大小关系为_________。
(3)利用合成气(主要成分为CO和H2)合成甲醇,主要发生如下反应:
CO(g)+2H2(g) ![]() CH3OH(g) △H1;
CH3OH(g) △H1;
CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2;
CO(g)+H2O(g) △H2;
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3。
CH3OH(g)+H2O(g) △H3。
上述反应对应的平衡常数分别为K1、K2、K3,其中K1、K2随温度的变化如图所示。
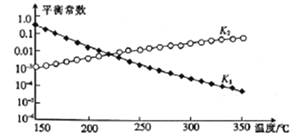
则△H1_____((填“>”“<”或“=”) △H3,理由是__________________。
【题目】我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,某实验小组拟提取靑蒿素并测定其化学式。
【査阅资料】青蒿素为无色针状晶体,熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取靑萵素的工艺流程如下图:
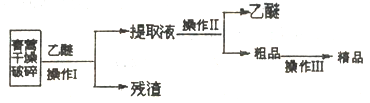
(1)在操作I前要对青蒿进行粉碎,其目的是____________。
(2)操作II的名称是_______________。
(3)操作III进行的是重结晶,其操作步骤为加热溶解→______→_______→过滤、洗涤、干燥。
II.己知青蒿素是一种烃的含氧衍生物,为确定其化学式,又进行了如下实验:
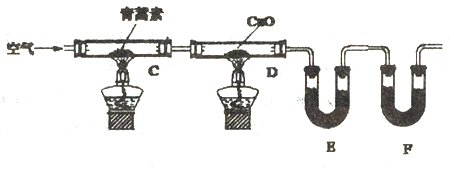
实验步骤
①连接装置,检査装置的气密性。
②称量E、F中仪器及药品的质量
③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量
(4)装置E、F应分别装入的药品为______、_________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100. 00g | 133.00g |
通过质谱法测得靑蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
(6)有同学认为使用上述方法会产生较大实验误差,你的改进方法是_______________。