题目内容
(08六都中学模拟)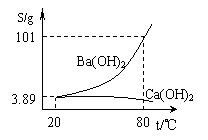 (6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(6分)实验室有一份混有少量碳酸钙杂质的碳酸钡样品。分离并提纯碳酸钡的实验步骤如下,请根据要求填空(下图为Ba(OH)2和Ca(OH)2的溶解度曲线):
⑴ 高温灼烧碳酸钡和碳酸钙的混合物,直至分解分解。所需仪器除坩埚、泥三角、玻璃棒、三脚架外还有 ;
⑵ 将灼烧后的固体混合物置于80℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是 ;
⑶ 将“⑵”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
⑷ 向制得的Ba(OH)2溶液中滴加 (填一种试剂名称),再通入二氧化 碳。当观察到 时,即可停止通二氧化碳。
⑸ 滤出碳酸钡沉淀,经洗涤、干燥后即得到纯净的碳酸钡。
答案: ⑴ 坩埚钳、酒精喷灯(答“酒精灯”不给分) ⑵ 趁热过滤 ⑶ 冷却结晶 ⑷酚酞 红色刚好消失(每空1分)

(08六都中学模拟)(13分)某学校化学兴趣小组同学在两支小试管中分别加入浓度为4mol/L稀盐酸3mL,将分别装有0.3gNaHCO3和0.3gNa2CO3粉末的小气球分别套在两支试管口。将气球内的NaHCO3和Na2CO3同时倒人试管中,观察到的现象及分析如下:
(1)比较两支试管中的现象: 。
(2)若两气球内的压强相同.两试管大小相同,则大小气球体积之比约为 (填最简整数比)
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变冷,而盛Na2CO3的试管温度升高。由此他得出:不管其状态如何,NaHCO3和HCl反应为吸热反应,而Na2CO3和HCl反应为放热反应。甲同学写出了下列热化学方程式(其中“aq”代表水合或无限稀释的含义):
HCO3-(aq)+H+(aq)=H2O(1)+CO2(g);△H>O;
CO32-(aq)+2H+(aq)=H2O(1)+CO2(g);△H<O;
甲分析结论的方法是否科学? 。(填“是”或“否”)
(4)为研究反应是吸热还是放热,乙同学继续进行下列实验。(每个实验平行做三次,取平均值)
序 号 | 试剂l | 试剂2 | 混合前温度 | 混合后最高或最低温度 |
1 | 35mL水 | 2.5gNaHCO3固体 | 20℃ | 18.5℃ |
2 | 35mL水 | 3.2gNa2CO3固体 | 20℃ | 24.3℃ |
3 | 35mL稀盐酸 | 含2.5g NaHCO3 的饱和溶液32.5ml | 20℃ | 19℃ |
4 | 35mL稀盐酸 | 含3.2g Na2CO3的饱和溶23.1mL+10mL水 | 20℃ | 24.2℃ |
5 | 35mL稀盐酸 | 2.5g NaHCO3固体 | 20℃ | 16.2℃ |
6 | 35mL稀盐酸 | 3.2gNa2CO3固体 | 20℃ | 25.1℃ |
请你帮助填写相关内容:
①该研究报告的题目是《 》
②通过上述实验可得出五条结论:
a.NaHCO3的溶解是 (“吸热”或“放热”)过程;
b.Na2CO3的溶解是 (“吸热”或“放热”)过程;
c.NaHCO3的饱和溶液和盐酸的反应是 (”吸热”或“放热”)反应;
d.Na2CO3的饱和溶液和盐酸的反应是 (“吸热”或“放热”)反应;
e.NaHCO3固体与稀盐酸反应的反应热是 (填a→d的字母)的热效应之和。
(08六都中学模拟)(12分)某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
实验步骤 | 实验现象 |
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
反应结束后分离出溶液备用 |
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:____________________________________;
化合反应:____________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可观察到的现象是_________________________________________。解释此现象的离子方程式是_____________________________________
_________________________________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式表示)______________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化后的H2O2溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是______________________________________。