题目内容
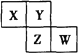
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。已知Y原子的最外层电子数是次外层的3倍。下列叙述正确的是
A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:Z>W>X
C. Y单质的沸点比Z单质的沸点高
D. W单质跟水反应形成的溶液具有漂白性
【答案】D
【解析】X、Y、Z、W均为短周期元素,Y原子的最外层电子数是次外层电子数的3倍,由于最外层电子数不能超过8,Y原子只能有2个电子层,次外层电子数为2,最外层电子数为6,则Y为O元素;由图中的位置可知,X为N元素,Z为S元素,W为Cl元素。A.同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;B.同周期元素从左到右元素的非金属性逐渐增强,元素的非金属性越强,对应最高价氧化物的水化物的酸性越强,可知最高价氧化物对应水化物的酸性:W>Z,故B错误;C.四种元素的单质中,常温下Z的单质是固体,其余均是气体,Z单质硫的熔、沸点最高,故C错误;D.氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,故D正确;故选D。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目