题目内容
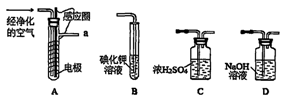
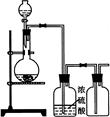
某同学用下列装置制备并检验Cl2的性质。

下列说法错误的是

下列说法错误的是
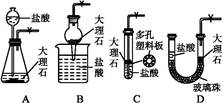
| A.Ⅰ图中:即使MnO2过量,盐酸也不能全部消耗 |
| B.Ⅱ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成 |
| C.Ⅲ图中:生成棕色的烟 |
| D.Ⅳ图中:水可以充满试管 |
D
试题分析:A、因为MnO2与浓盐酸反应,所以随着反应的进行,浓盐酸变为稀盐酸时,反应停止,正确;B、Cl2与H2O反应生成的HClO具有漂白性,能使湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,NaCl、NaClO与H2SO4反应生成Cl2,正确;C、铜丝在氯气中燃烧,产生棕色的烟,正确;D、Cl2与H2O反应生成HCl和HClO,HClO分解生成O2,所以水不可能充满试管,错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 2O3)。
2O3)。