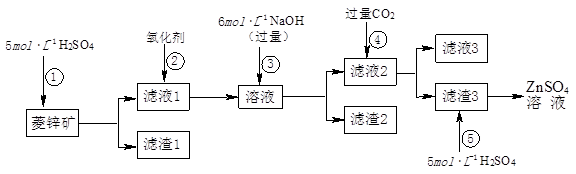��Ŀ����
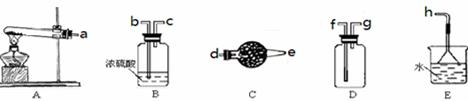
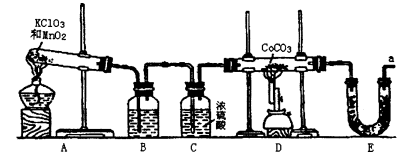
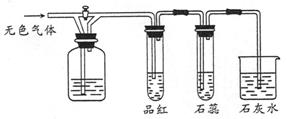
ʵ�����Կ�����O2�������20%)Ϊԭ�ϣ�����̼����ˮ�Ļ����£�����ͼAװ���Ʊ�������3O2 2O3����
2O3����
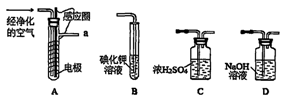
��1������ͨ��Aװ��֮ǰ��Ӧ�Ⱥ�ͨ������װ���е� �� ����װ����ţ���
��2��������⻯����Һ��ӦΪ��2KI+O3+H2O=2KOH+I2+O2����a������ͨ��װ��B����Һ�е�����Ϊ ��
��3��Ϊ�ⶨO2ת��ΪO3��ת���ʣ���װ��B�е���Һȫ��ת����һ�����У�����CC14������ȡ����Һ��������ȴ�����أ���I2����0.254g��
����ȡ�������ò������������� ��
����ʵ��ʱͨ�����1.12L����״������O2��ת����Ϊ ��
�۲ⶨʱ����A��Bװ�ü�����װ��D��ԭ���� ��
��4����ҵ�Ϸ���O3��O2���ɽ��������Һ�����ٷ��룬���з��뷽���������� ������ţ���
A�����ˡ�B������C����Һ��D����ȡ
��5�����������ں�CNһ���Ե�Ʒ�ˮ�Ĵ�������i����CNһת��ΪOCN������ii����OCNһ����ת��ΪCO32һ�����ֵ������塣����ii��ת��ʱ��O3��OCN�����ʵ�����֮��Ϊ3��2���ò���Ӧ�����ӷ���ʽΪ ��
 2O3����
2O3����
��1������ͨ��Aװ��֮ǰ��Ӧ�Ⱥ�ͨ������װ���е� �� ����װ����ţ���
��2��������⻯����Һ��ӦΪ��2KI+O3+H2O=2KOH+I2+O2����a������ͨ��װ��B����Һ�е�����Ϊ ��
��3��Ϊ�ⶨO2ת��ΪO3��ת���ʣ���װ��B�е���Һȫ��ת����һ�����У�����CC14������ȡ����Һ��������ȴ�����أ���I2����0.254g��
����ȡ�������ò������������� ��
����ʵ��ʱͨ�����1.12L����״������O2��ת����Ϊ ��
�۲ⶨʱ����A��Bװ�ü�����װ��D��ԭ���� ��
��4����ҵ�Ϸ���O3��O2���ɽ��������Һ�����ٷ��룬���з��뷽���������� ������ţ���
A�����ˡ�B������C����Һ��D����ȡ
��5�����������ں�CNһ���Ե�Ʒ�ˮ�Ĵ�������i����CNһת��ΪOCN������ii����OCNһ����ת��ΪCO32һ�����ֵ������塣����ii��ת��ʱ��O3��OCN�����ʵ�����֮��Ϊ3��2���ò���Ӧ�����ӷ���ʽΪ ��
��15�֣���1��D��C����1�֣�2�֣�
��2����Һ���ɫ�����������𰸸��֣�2�֣�
��3���ٷ�Һ©����1�֣�
��15%��3�֣�
�۳�ȥ��������еĵ���������������𰸸��֣�2�֣�
��4��B��2�֣�
��5��2OCN��+2OH��+3O3=2CO32һ+N2+3O2+H2O��3�֣�
��2����Һ���ɫ�����������𰸸��֣�2�֣�
��3���ٷ�Һ©����1�֣�
��15%��3�֣�
�۳�ȥ��������еĵ���������������𰸸��֣�2�֣�
��4��B��2�֣�
��5��2OCN��+2OH��+3O3=2CO32һ+N2+3O2+H2O��3�֣�
�����������1��������̼��ˮ���������������ͨ��Aװ��ǰӦ�Ⱥ�ͨ��NaOH��Һ��ŨH2SO4��ϴ��ƿ����2��a������ͨ��B������������KI����Һ�������ɵ�I2��ƣ���3������ȡʹ�÷�Һ©�����ձ�������m/M��֪n(I2)=0.254g��254g/mol=0.001mol����2KI+O3+H2O=2KOH+I2+O2��֪��n(O3)=0.001mol����3O2
 2O3��֪��n(O2)=0.0015mol����V/Vm��֪n(����)=0.05mol���ɿ�������ɿ�֪��n(O2)=0.01mol�����O2��ת����Ϊ0.0015��0.01��100%=15%����NaOH��Һ�ܳ�ȥ�����е����������ڷŵ�ʱ�����ĵ��������ֹNO2��KI��Һ��Ӧ����4��������������Һ�������߷е㲻ͬ�����÷���ķ������룬��B��ȷ����5����һ����Ӧ��̼Ԫ����+2����Ϊ+4�ۣ��ڶ�����Ӧ�е�Ԫ���ɡ�3����Ϊ0�ۣ�������Ԫ����0�۽�Ϊ��2�ۣ���������Ӧ�ֱ�ΪO3+CN��=OCN��+O2��2OCN��+2OH��+3O3=2CO32һ+N2+3O2+H2O��
2O3��֪��n(O2)=0.0015mol����V/Vm��֪n(����)=0.05mol���ɿ�������ɿ�֪��n(O2)=0.01mol�����O2��ת����Ϊ0.0015��0.01��100%=15%����NaOH��Һ�ܳ�ȥ�����е����������ڷŵ�ʱ�����ĵ��������ֹNO2��KI��Һ��Ӧ����4��������������Һ�������߷е㲻ͬ�����÷���ķ������룬��B��ȷ����5����һ����Ӧ��̼Ԫ����+2����Ϊ+4�ۣ��ڶ�����Ӧ�е�Ԫ���ɡ�3����Ϊ0�ۣ�������Ԫ����0�۽�Ϊ��2�ۣ���������Ӧ�ֱ�ΪO3+CN��=OCN��+O2��2OCN��+2OH��+3O3=2CO32һ+N2+3O2+H2O��
��ϰ��ϵ�д�
 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д� ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д�
�����Ŀ