题目内容
(1)25℃时,①醋酸②次氯酸③氢氟酸的电离常数分别是1.8×10-5、3.0×10-8、3.5×10-4.请推测:
A.它们的酸性由强到弱的顺序为 (填序号,下同),
B.氢离子浓度相同的溶液中,酸的浓度最大的是 .
(2)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b满足的关系 .
(3)常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-.根据题意回答下列问题:
①若溶液M由0.1mol?L-1的HA溶液与0.1mol?L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”).
②常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是 (填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2.
A.它们的酸性由强到弱的顺序为
B.氢离子浓度相同的溶液中,酸的浓度最大的是
(2)25℃时,pH=a的10体积的某强酸与pH=b的1体积的某强碱混合后,溶液呈中性,则a和b满足的关系
(3)常温下,某水溶液M中存在的离子有Na+、A-、H+、OH-.根据题意回答下列问题:
①若溶液M由0.1mol?L-1的HA溶液与0.1mol?L-1的NaOH溶液等体积混合而得,则溶液M的pH不可能
②常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+)+c(OH-)=2×10-7mol?L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2.
考点:酸碱混合时的定性判断及有关ph的计算,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:(1)酸的电离平衡常数越大,其电离程度越大,则酸性越强,其酸根离子水解能力越小;
(2)强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,根据物质的量相等计算;
(3)①先计算溶液中氢离子浓度,再根据pH公式计算pH;
②A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
(2)强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,根据物质的量相等计算;
(3)①先计算溶液中氢离子浓度,再根据pH公式计算pH;
②A.若混合溶液呈中性,则氢离子浓度等于氢氧根离子浓度;
B.如果二者体积相等,根据酸的强弱判断混合溶液的酸碱性;
C.如果溶液呈酸性,则溶液可能是酸和盐溶液;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液.
解答:
解:(1)A.相同温度下,酸的电离平衡常数越大,其酸性越强,根据电离平衡常数知,酸性强弱顺序是:③>①>②,
故答案为:③>①>②;
B.同pH的三种酸,酸的电离平衡常数越小,酸的浓度越大,所以酸浓度最大的是次氯酸,
故答案为:②;
(2)25℃时,强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,
设酸的体积为10VL,碱的体积为VL,酸中氢离子浓度=10-a mol/L,碱中氢氧根离子浓度=10b-14 mol/L,
10-a mol/L×10V=10b-14 mol/L×VL,
则a+b=15,
故答案为:a+b=15;
(3)①如果酸是强酸,等浓度等体积的二者混合恰好反应生成强酸强碱盐,混合溶液呈中性,如果酸是弱酸,则生成的盐是强碱弱酸盐,其溶液呈碱性,所以则溶液M的pH不可能小于7,
故答案为:小于;
②A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,故A正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD.
故答案为:③>①>②;
B.同pH的三种酸,酸的电离平衡常数越小,酸的浓度越大,所以酸浓度最大的是次氯酸,
故答案为:②;
(2)25℃时,强酸和强碱混合溶液呈中性,说明酸中氢离子的物质的量等于碱中氢氧根离子的物质的量,
设酸的体积为10VL,碱的体积为VL,酸中氢离子浓度=10-a mol/L,碱中氢氧根离子浓度=10b-14 mol/L,
10-a mol/L×10V=10b-14 mol/L×VL,
则a+b=15,
故答案为:a+b=15;
(3)①如果酸是强酸,等浓度等体积的二者混合恰好反应生成强酸强碱盐,混合溶液呈中性,如果酸是弱酸,则生成的盐是强碱弱酸盐,其溶液呈碱性,所以则溶液M的pH不可能小于7,
故答案为:小于;
②A.若混合溶液呈中性,则溶液M中c(H+)=c(OH-)=1×10-7 mol?L-1,所以溶液M中c(H+)+c(OH-)=2×10-7 mol?L-1,故A正确;
B.如果二者体积相等,如果酸是强酸,则混合溶液呈中性,如果酸是弱酸,则混合溶液呈酸性,故B错误;
C.如果溶液呈酸性,则溶液是酸和盐溶液,酸是弱酸,酸浓度大于氢氧化钠浓度,所以V1不一定大于V2,故C错误;
D.如果溶液呈碱性,则溶液可能是碱和盐溶液,也可能只是盐溶液,则V1一定小于V2,故D正确;
故答案为:AD.
点评:本题考查了酸碱混合溶液定性判断,明确弱电解质电离特点及溶液中的溶质性质即可解答,注意强酸强碱混合溶液中pH的计算方法,难度中等.

练习册系列答案
相关题目
230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U.下列有关Th的说法正确的是( )
| A、230Th的中子数比核外电子数多140 |
| B、230Th和232Th的化学性质相同 |
| C、232Th转换成233U是化学变化 |
| D、Th元素的相对原子质量是231 |

 Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3?H2O、NH4HSO4、NaOH、CH3COOH,
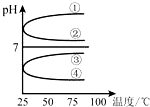
 A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题