题目内容
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是( )
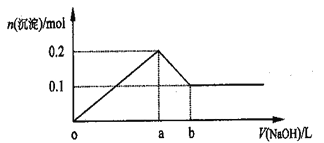
A. NaOH的浓度为0.6mol/L
B. 图中线段oa:ab=5:1
C. 在a点处溶液中的溶质为NaCl
D. 在b点处溶液中的溶质只有Na[Al(OH)4]
【答案】D
【解析】
AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液,发生反应生成氢氧化铝、氢氧化镁沉淀,加入aLNaOH溶液时,沉淀达最大值共0.2mol,此时溶液为NaCl溶液,继续滴加NaOH溶液直至过量,氢氧化铝与NaOH反应逐渐溶解,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、Na[Al(OH)4]溶液,据此分析。
A.在bL时,溶液为NaCl、Na[Al(OH)4]溶液,由图象可以知道:n[(Al(OH)3]=0.1mol,n[(Mg(OH)2]=0.1mol,根据Mg原子守恒有n(MgCl2)=n[(Mg(OH)2]=0.1mol,根据Al原子守恒有n(NaAlO2)=n(AlCl3)=n[(Al(OH)3]=0.1mol,由Cl原子守恒有n(Cl)=n(NaCl)=2n(MgCl2)+3 n(AlCl3)=2×0.1+3×0.1=0.5mol;由Na原子守恒有n(NaOH)=n(NaCl)+ n(NaAlO2)=0.5+0.1=0.6mol,所以c(NaOH)=0.6/1=0.6 mol/L,故A正确;
B.加入aLNaOH溶液时,沉淀达最大值共0.2mol,由反应方程式可以知道,此时溶液为NaCl溶液,在bL时,即再继续滴加NaOH溶液(b-a)L时,氢氧化铝与NaOH恰好反应,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、NaAlO2溶液,所以两部分NaOH溶液的体积之比等于消耗的NaOH的物质的量之比,即为n(NaCl)与n(NaAlO2)之比,故图中线段oa:ab=a:(b-a)=5:1,故B正确;
C.加入aLNaOH溶液时,沉淀达最大值共0.2mol,由反应方程式可以知道,此时溶液为NaCl溶液,故C正确;
D.在bL时,即再继续滴加NaOH溶液(b-a)L 时,氢氧化铝完全溶解,沉淀为氢氧化镁0.1mol,溶液为NaCl、Na[Al(OH)4]溶液,故D错误;
综上所述,本题选D。

 名校课堂系列答案
名校课堂系列答案【题目】某学生用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作如下: ①用标准溶液润洗滴定管2-3 次,取标准NaOH 溶液注入碱式滴定管至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“0”或“0”刻度线稍下,并记下读数;④量取20.00mL待测液注入清净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数;⑥重复以上滴定操作2-3 次。
请回答下列问题:
(1)步骤④中,若在取盐酸的滴定管尖嘴部分有气泡且取液结束前气泡消失,则测定结果____(填“偏大”、“偏小”或“无景响”)。
(2)判断到达滴定路点的依据是____________。
(3)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 21.10 |
2 | 20.00 | 0.00 | 19.40 |
3 | 20.00 | 0.00 | 19.32 |
以上表可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是__________
A.NaOH 标准液保存时间过长,有部分变质
B.锥形瓶用待测液润洗
C.配制NaOH 标准液所用的药品中混有KOH固体
D.滴定结束时,俯视读数
(4)根据上表记录数据,通过计算可得,该盐酸浓度为_____mol/L。
(5)室温下,用0.100mol/LNaOH溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是_________
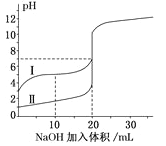
A.V(NaOH)=20mL时,c(Cl-)=c(CH3COO-)
B.I表示的是滴定盐酸的曲线
c.pH=7时,滴定醋酸消耗V(NaOH)小于20mL
D.V(NaOH)=10mL时,醋酸溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)