题目内容
下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
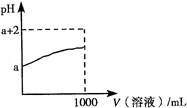
C. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D. 向0.1
mol/L的氨水中加入少量硫酸铵固体,则溶液中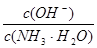 增大
增大
【答案】
B
【解析】
试题分析:根据电荷守恒可知,A中应该是2c(SO42-)=c(NH4+),A不正确;醋酸是弱酸,所以pH=3的醋酸溶液的浓度对于0.001mol/L,因此反应后醋酸是过量的,溶液显酸性,B正确;C不正确,稀释促进电离,所以C中应该是c1>10c2,C不正确;D中,硫酸铵能抑制氨水的电离,溶液中 降低,答案选B。
降低,答案选B。
考点:考查外界条件对平衡状态的影响。
点评:在判断外界条件对平衡状态的影响是,应该依据勒夏特例原理进行有关的判断,因为该冶炼适用于所有的平衡体系。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
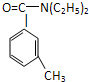 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH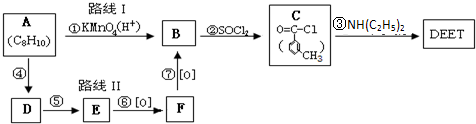
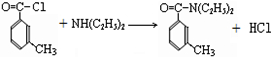
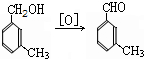
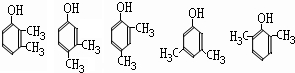 (任写2种)
(任写2种)
 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.