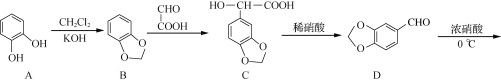
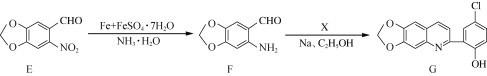
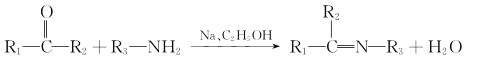��Ŀ����
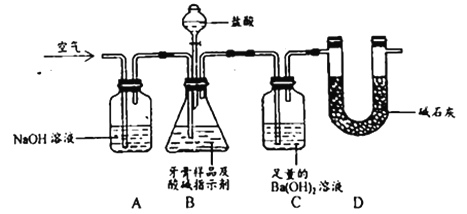
����Ŀ����֪��Ӧ:2NO2(g) ![]() N2O4(g)�Ƿ��ȷ�Ӧ,Ϊ��̽���¶ȶԻ�ѧƽ���Ӱ��,������������ʵ��:��NO2��N2O4�Ļ������ͨ��ס���������ͨ����ƿ��,Ȼ���ü��Ӽ�ס��Ƥ��,������ƿ�ֱ���������ֱ�ʢ��500 mL 6 mol��L-1��HCl��Һ��ʢ��500 mL����ˮ���ձ���(���ձ�����Һ���¶���ͬ)��
N2O4(g)�Ƿ��ȷ�Ӧ,Ϊ��̽���¶ȶԻ�ѧƽ���Ӱ��,������������ʵ��:��NO2��N2O4�Ļ������ͨ��ס���������ͨ����ƿ��,Ȼ���ü��Ӽ�ס��Ƥ��,������ƿ�ֱ���������ֱ�ʢ��500 mL 6 mol��L-1��HCl��Һ��ʢ��500 mL����ˮ���ձ���(���ձ�����Һ���¶���ͬ)��
��1����ʵ����������������ͨ����ƿ,�������ͼ��__________��
��2�����ձ�����Һ�з���125g NaOH����,ͬʱ���ձ����з���125g����茶���,����ʹ֮�ܽ⡣����ƿ���������ɫ��__________ԭ����__________����ƿ���������ɫ��__________,ԭ����__________��
��3����ʵ�����ó��Ľ�����__________��
��4��ijͬѧ��Ϊ��ʵ�����Ʋ�����ȫ��ѧ,��ָ����ʱӰ�컯ѧƽ������ز�ֹһ��,����Ϊ����ָ����һ��������__________��
���𰸡�ʹ������ƿ����ʼ״̬��ȫ��ͬ���������� ���� NaOH�ܽ���ȣ��к�HClҲ���ȣ�ʹ��ƿ�����¶����ߣ�ƽ�������ƶ���c��NO2������ ��dz NH4NO3�ܽ����ȣ�����ƿ������¶Ƚ��ͣ�ƽ��������N2O4�����ƶ���ʹNO2��Ũ�ȼ�С�� ����ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ� ѹǿ
��������
��1����������������������ͨ����ƿ������ʹ������ƿ����ʼ״̬��ȫ��ͬ���������ã���2�������¶ȶԻ�ѧƽ���Ӱ����������������ܽ�����ᷢ���кͷ�Ӧ����ʹ��Һ�¶����ߣ�������ܽ�ʹ��Һ�¶Ƚ��ͣ���2NO2��g��N2O4��g����H��0�����ݻ�ѧƽ���ƶ�ԭ������������ƽ�������ȷ�����У�����ƽ������ȷ�Ӧ������У����������Ǻ���ɫ���壬��������������ɫ���壻��3�������¶ȶԿ��淴Ӧ��Ӱ����з�������4���÷�Ӧ����������룬�¶ȸı���������Ҳ�ı䣬ѹǿҲ��Ӱ�컯ѧƽ�⣮
��1����ʵ����������������ͨ����ƿ,�������ͼ�ǿ���ʹ������ƿ����ʼ״̬��ȫ��ͬ���������ã��ʴ�Ϊ��ʹ������ƿ����ʼ״̬��ȫ��ͬ������������
��2����NaOH����ˮ�Լ���NaOH��HCl�ķ�Ӧ����ʹ��Һ�¶����ߣ������ձ�������Һ���¶����ߣ��¶����ߣ�ƽ��2NO2��g��N2O4��g����H��0�����ȷ����ƶ��������淴Ӧ�����ƶ���NO2Ũ��������ɫ�����NH4NO3����ˮ�����ȵģ�ʹ��ϵ�¶Ƚ��ͣ�2NO2��g��N2O4��g����H��0����ȷ����ƶ�����������Ӧ�����ƶ���NO2Ũ�ȼ�С����ɫ��dz���ʴ�Ϊ�����NaOH�ܽ���ȣ��к�HClҲ���ȣ�ʹ��ƿ�����¶����ߣ�ƽ�������ƶ���c��NO2������dz��NH4NO3�ܽ����ȣ�����ƿ������¶Ƚ��ͣ�ƽ��������N2O4�����ƶ���ʹNO2��Ũ�ȼ�С��
��3������ʵ�������֪���ı��¶Ⱥ�ѧƽ�ⷢ���ƶ�������ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ����ʴ�Ϊ������ƽ�������ȷ����ƶ�������ƽ������ȷ����ƶ���
��4���÷�Ӧ�У��ı��¶Ⱥ������������ѹǿҲ��ı䣬��ѹǿ�Ըÿ��淴Ӧͬ�������Ӱ�죬���Ը�ʵ����Ʋ�����ȫ��ѧ���ʴ�Ϊ��ѹǿ��

 ��Ӣ���㿨ϵ�д�
��Ӣ���㿨ϵ�д�����Ŀ����2 L���ܱ������ڣ�800��ʱ��Ӧ2NO(g)��O2(g)![]()
![]()
![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽ��K��_____________________����֪��K300����K350������÷�Ӧ��______�ȷ�Ӧ��
��2����ͼ��ʾNO2�ı仯��������_______����O2��ʾ��0��2 s�ڸ÷�Ӧ��ƽ������v��_______________��
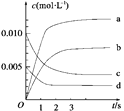
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����________��
a��v(NO2)��2v(O2) b��������ѹǿ���ֲ���
c��v��(NO)��2v��(O2) d���������ܶȱ��ֲ���
��4��Ϊʹ�÷�Ӧ�ķ�Ӧ����������ƽ��������Ӧ�����ƶ�����________��
a����ʱ�����NO2���� b���ʵ������¶� c������O2��Ũ�� d��ѡ���Ч����