题目内容
4.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )| A. | 将40gNaOH溶于1L水所得的溶液 | |
| B. | 常温常压下,将22.4LHCl气体溶于水配成1L盐酸溶液 | |
| C. | 将23gNa溶于水并配成1L溶液 | |
| D. | 含K+为1 mol•L-1的K2SO4溶液 |
分析 A、C=$\frac{\frac{m}{M}}{V}$中,体积指溶液体积不是溶剂体积.
B、根据温度、压强对气体摩尔体积的影响分析判断,标准状况气体摩尔体积为22.4L/mol;
C、将23gNa溶于水并配成1L溶液,溶质为钠和水反应生成的氢氧化钠,物质的量n(Na)=n(NaOH)=$\frac{23g}{23g/mol}$=1mol,溶液体积为1L,计算浓度分析;
D、强电解质溶液中离子浓度=溶质浓度×溶质完全电离出的离子数;
解答 A、将40gNaOH溶于1L水所得的溶液,溶质物质的量=$\frac{40g}{40g/mol}$=1mol,体积指溶液体积不是溶剂体积,溶液体积不是1L,溶液浓度不是1mol/L,故A错误;
B、标准状况气体摩尔体积为22.4L/mol,常温常压下,22.4LHCl气体物质的量不是1mol,故B错误;
C、将23gNa溶于水并配成1L溶液,溶质为钠和水反应生成的氢氧化钠,物质的量n(Na)=n(NaOH)=$\frac{23g}{23g/mol}$=1mol,溶液体积为1L,计算浓度=$\frac{1mol}{1L}$=1mol/L,故C正确;
D、强电解质溶液中离子浓度=溶质浓度×溶质完全电离出的离子数,含K+为1 mol•L-1的K2SO4溶液中溶质浓度为0.5mol/L,故D错误;
故选C.
点评 本题考查了有关物质的量浓度的问题,难度不大,注意溶液的浓度有均一性,与取出溶液的体积大小无关.

练习册系列答案
相关题目
12.试回答下列各题:
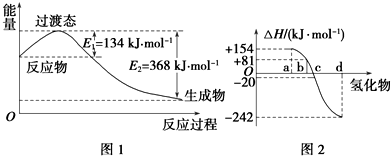
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)
△H=-185kJ•mol-1
请填空:
②H-Cl的键能是432kJ•mol-1
③图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定
a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.
(1)如图1所示是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234kJ/mol.
(2)化学反应的焓变与反应物和生成物的键能有关.
①已知:H2(g)+Cl2(g)═2HCl(g)
△H=-185kJ•mol-1

请填空:
| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 432 |
③图2中表示氧族元素中氧、硫、硒、碲生成氢化物时的焓变数据,根据焓变数据可确定
a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准状态下,发生分解反应的热化学方程式:H2Se(g)=Se(s)+H2(g)△H=-81kJ/mol.
(3)已知:Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)
△H=-25kJ•mol-1①
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)
△H=-47kJ•mol-1②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)
△H=+19kJ•mol-1③
请写出CO还原FeO的热化学方程式:FeO(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol.
19.现在人类直接利用主要的化石能源是( )
| A. | 太阳能 | B. | 核能 | C. | 氢能 | D. | 煤 |
16.下列反应方程式表示正确的是( )
| A. | 酸碱中和反应的离子方程式都可表示为:OH-+H+═H2O | |
| B. | NaHCO3在水溶液中电离过程:NaHCO3═CO32-+H++Na+ | |
| C. | 氯化铁溶液中加入KSCN溶液:3SCN-+Fe3+═Fe(SCN)3↓ | |
| D. | 酸化的淀粉KI溶液放置于空气中变蓝:4H++4I-+O2═2I2+2H2O |
14.下列说法正确的是( )
| A. | 0.5 mol O3与11.2 L O2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)═2SO3(g)和4SO2(g)+2O2(g)═4SO3(g)的△H相等 |

