题目内容
【题目】短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+ 电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体,回答下列问题:
(1)M元素位于周期表中的第________ 周期________ 族.
(2)Z元素的符号是 ________ ,其在自然界中常见的二元化合物是________ (写化学式) .
(3)X与M的单质在高温下反应的化学方程式为________,产物分子为直线形,其化学键属___ 共价键(填“极性”或“非极性”).
(4)四种元素中的________(写名称) 可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为________________________ .
【答案】三 VIA Si SiO2 C+2S ![]() CS2 极性 镁 Mg+2HCl═MgCl2+H2↑
CS2 极性 镁 Mg+2HCl═MgCl2+H2↑
【解析】
短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,则X是C元素;Y2+电子层结构与氖相同,则Y是Mg元素;Z的质子数为偶数,室温下M单质为淡黄色固体,则Z是Si元素;M是S元素。
(1)M元素是S,核外电子排布是2、8、6,所以位于周期表中的第三周期、VIA族;
(2)Z元素是Si元素,其在自然界中常见的二元化合物是SiO2;
(3)X与M的单质在高温下反应产生CS2,该反应的化学方程式为C+2S ![]() CS2,产物分子为直线形,结构与CO2类似,由于是不同元素的原子形成的共价键,所以其化学键属于极性共价键;
CS2,产物分子为直线形,结构与CO2类似,由于是不同元素的原子形成的共价键,所以其化学键属于极性共价键;
(4)四种元素中只有Mg是金属元素,密度比较小,制成的合金硬度大,所以可用于航空航天合金材料的制备,该金属是比较活泼的金属,可以与盐酸发生置换反应产生氢气,其单质与稀盐酸反应的化学方程式为Mg+2HCl═MgCl2+H2↑。

 金牌教辅培优优选卷期末冲刺100分系列答案
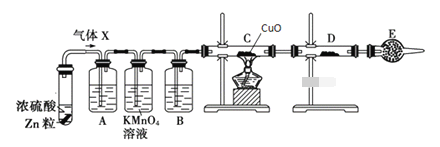
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某学习小组查阅资料加。大多数硝酸盐不稳定。受热易分解,分解产物与金属活动顺序有关)了探究硝酸铁分解产物。他们进行如下探究:
(一)探究气体产物
[提出假设]
他们对气体产物提出如下猜想:
猜想1:气体为NO2
猜想2:气体为NO和O2
猜想3:气体为NO和NO2
清想4:气体为NO2和O2
猜想5:气体为NO
(1)他们经过讨论,认为猜想2不成立。理由是_______;根据氧化还原反应原理,不成立的猜想还有__________
[查阅资料]
①几种气体熔点。沸点如下:
气体 | NO | NO2 | O2 |
熔点/℃ | -163.6 | -11.2 | |
沸点/℃ | -151 | 21.1 | -183 |
②2NO2(g) ![]() N2O4(g)(无色) ΔH<0
N2O4(g)(无色) ΔH<0
[设计实验]
加热装置省略(冰盐冷却剂温度约为-5℃)

取一定量无水硝酸铁粉术进行实验,实验结果: A中U型管收集到少量液体物质;B中排水法收集一部分气体
(2)本实验的橡胶寨、导管接口处都用锡箔纸包裹,其目的是___________
(3)实验完毕,取出U型管,打开塞子。观察到有棕色气体产生,则U型管内的气体是_____
向U型管加入_____能吸收该物质。避免污染环境。
(4)检验B瓶收集气体为氧气的操作方法是__________
(二)探究固体成分
分析固体中铁元素价态,可能有种情况:①+2价②+3价③+2价和+3价。
为了探究固体中铁元素价态。甲、乙同学设计如下方案:
步骤 | 现象 | |
甲 | 取少量样品于试管,加入适量稀硫酸使固体完全溶解,再滴加酸性高锰酸钾溶液 | 溶液无明显颜色变化 |
乙 | 取少量样品于试管,加入稀盐酸使固体完全溶解,滴加KSCN溶液 | 溶液变红色 |
(5)上述实验,不能确定固体成分的实验是______(填“甲”或“乙”);根据上迷实验结论。写出硝酸铁分解反应的化学方程式______________