题目内容
14.L、M、R、T、W是原子序数依次增大的短周期元素,M、T在周期表中的相对位置如表,L与R原子的最外层电子数相同,R的单质是一种常见的半导体材料;M和T的氧化物是常见的引起酸雨的大气污染物.请回答下列问题:| M | |
| T |
 ;元素W在周期表中的位置是第三周期第ⅦA族.
;元素W在周期表中的位置是第三周期第ⅦA族.M的气态氢化物与最高价氧化物的水化物能形成一种离子化合物,该离子化合物的化学式为NH4NO3.
(2)在加热条件下,L的单质与T的最高价氧化物的水化物的浓溶液反应的化学方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
L的单质能置换出R的单质,请写出对应的方程式2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(3)下列有关相应元素非金属性强弱比较的说法正确的是AC(填字母)
A.M的气态氢化物比R的气态氢化物稳定,则非金属性M强于R
B.高温下,L的单质能从R的最高价氧化物中置换出R,则非金属性L强于R
C.W的核电荷数比T多,原子半径比T小,得电子能力强,则非金属性W强于T.
分析 L、M、R、T、W是原子序数依次增大的短周期主族元素,R的单质是一种常见的半导体材料,则R为Si,L与R原子的最外层电子数相同,二者同主族,则L为C元素,结合M、T在周期表中的相对位置,可知M处于第二周期,T处于第三周期,M只能处于ⅤA族,T、W分别处于ⅥA、ⅦA族,可推知M为N元素、T为S元素、W为Cl,据此解答.
解答 解:L、M、R、T、W是原子序数依次增大的短周期主族元素,R的单质是一种常见的半导体材料,则R为Si,L与R原子的最外层电子数相同,二者同主族,则L为C元素,结合M、T在周期表中的相对位置,可知M处于第二周期,T处于第三周期,M只能处于ⅤA族,T、W分别处于ⅥA、ⅦA族,可推知M为N元素、T为S元素、W为Cl.
(1)S2-离子的结构示意图为 ,元素Cl在周期表中位于第三周期第ⅦA族,M的气态氢化物与最高价氧化物的水化物能形成一种离子化合物,该离子化合物的化学式为NH4NO3,
,元素Cl在周期表中位于第三周期第ⅦA族,M的气态氢化物与最高价氧化物的水化物能形成一种离子化合物,该离子化合物的化学式为NH4NO3,
故答案为: ;第三周期第ⅦA族;NH4NO3;
;第三周期第ⅦA族;NH4NO3;
(2)在加热条件下,碳与浓硫酸反应生成二氧化硫、二氧化碳与水,反应方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,碳的单质能置换出Si的单质,反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)A.M的气态氢化物比R的气态氢化物稳定,非金属性越强氢化物越稳定,则非金属性M强于R,故A正确;
B.高温下,L的单质能从R的最高价氧化物中置换出R,高温条件改变了物质的性质,不能说明非金属性L强于R,故B错误;
C.W的核电荷数比T多,原子半径比T小,W原子核对核外电子吸引越强,得电子能力强,则非金属性W强于T,故C正确;
故答案为:AC.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,(3)中B选项为易错点,学生容易根据置换反应判断,忽略外界条件对物质性质的影响,难度中等.

 如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )
如图在盛有溴水的三支试管中分别加入汽油、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )| A. | ①加入的是CCl4,②加汽油,③加酒精 | B. | ①加入的是汽油,②加CCl4,③加酒精 | ||
| C. | ①加入的是汽油,②加酒精,③加CCl4 | D. | ①加入的是酒精,②加CCl4,③加汽油 |

| A. | 含有大量SO42-的溶液中肯定不存在Ag+ | |
| B. | 0.02 mol•L-1的AgNO3溶液与0.02 mol•L-1的Na2SO4 溶液等体积混合不会生成沉淀 | |
| C. | Ag2SO4的溶度积常数(Ksp)为1×10-3 | |
| D. | a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点 |
| 实验方法 | 实验方案 | 测量数据 | |
| A. | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| B. | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C. | 重量法 | 样品放入烧瓶中,置于电子天平上,加入足量盐酸 | 减轻的质量 |
| D. | 滴定法 | 将样品配成100mL溶液,取10mL加入酚酞,用标准盐酸确定 | 消耗盐酸的体积 |
| A. | A | B. | B | C. | C | D. | D |
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
(2)写出C元素的单质的电子式
 .
.(3)元素D与元素A相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b(填选项序号).
a.常温下D的单质和A的单质状态不同
b.D的氢化物比A的氢化物稳定
c.一定条件下D和A的单质都能与钠反应
(4)探寻物质的性质差异性是学习的重要方法之一.A、B、C、D四种元素的最高价氧化物 的水化物中化学性质明显不同于其他三种的是H2CO3(写化学式).
| A. | 1.4 g | B. | 2.8 g | ||
| C. | 4.4 g | D. | 在1.4 g和2.8 g之间 |
 苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
苯甲酸和苯甲酸钠均是食品防腐剂.某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应.
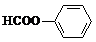 +2NaOH-→HCOONa+
+2NaOH-→HCOONa+ +H2O.
+H2O. ),乳酸在微生物作用下分解为CO2和H2O.
),乳酸在微生物作用下分解为CO2和H2O.
 乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n
乳酸在一定条件下发生反应得到聚乳酸的化学方程式是n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ +(n-1)H2O.
+(n-1)H2O.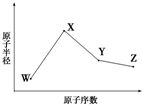 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.