题目内容
(6分)某氧化铝样品中含有氧化铁和二氧化硅杂质,现欲制取纯净的氧化铝,某同学设计如下的实验方案。回答下列问题:
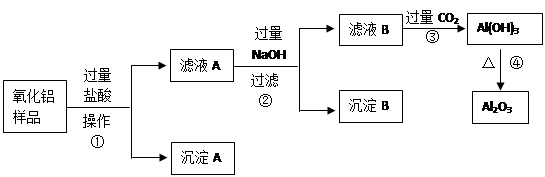
(1)操作①的名称 ;
(2)沉淀A的化学式是___________,滤液B中的阴离子除了Cl—、OH—外还有______________;
(3)步骤④的化学方程式为______________________________________;
(4)在操作②中要用到的玻璃仪器除了烧杯、玻璃棒,还有_________________。

(1)操作①的名称 ;
(2)沉淀A的化学式是___________,滤液B中的阴离子除了Cl—、OH—外还有______________;
(3)步骤④的化学方程式为______________________________________;
(4)在操作②中要用到的玻璃仪器除了烧杯、玻璃棒,还有_________________。
(1)过虑 (2)SiO2 AlO2- (3)2Al(OH)3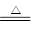 Al2O3 + 3H2O (4)普通漏斗
Al2O3 + 3H2O (4)普通漏斗
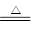 Al2O3 + 3H2O (4)普通漏斗
Al2O3 + 3H2O (4)普通漏斗二氧化硅不溶于盐酸,通过过滤即得到沉淀A。滤液中含有的是过量的盐酸,生成的氯化铁和氯化铝。加入过量的氢氧化钠溶液后氯化铁生成氢氧化铁沉淀,氯化铝生成偏铝酸钠,过滤即得到氢氧化铁沉淀。此时滤液中含有过滤的氢氧化钠和生成偏铝酸钠以及氯化钠,通入过量的二氧化碳即可以生成氢氧化铝沉淀。氢氧化铝不稳定,加热分解生成氧化铝。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
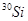 的原子的中子数为_________;
的原子的中子数为_________;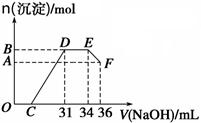
 测定生成气体的体积为69.44L(标准状况)
测定生成气体的体积为69.44L(标准状况) 过滤,测定沉淀的质量为5.8g
过滤,测定沉淀的质量为5.8g