题目内容
【题目】如图为元素周期表的一部分,已知A、B、C、D均为短周期元素,A与D的原子序数之和是C的原子序数的1.5倍。
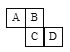
(1)A、B、C、D的简单气态氢化物中最不稳定的是__________(写化学式)。
(2)A、D两种元素的简单气态氢化物相互反应的化学方程式为___________________,现象为___________;产物的电子式为____________。
(3)写出下列物质的电子式:D的气态氢化物______________。A的单质_____________。
【答案】 H2S NH3+HCl=NH4Cl 冒白烟 ![]()
![]()
![]()
【解析】本题考查元素周期表的结构和元素周期律的应用,令A的原子序数为a,则B为a+1,C为a+9,D为a+10,根据题意得出:a+a+10=(a+9)×1.5,解得a=7,则A、B、C、D分别是N、O、S、Cl,(1)四种元素气态氢化物分别是NH3、H2O、H2S、HCl,非金属性越强,其氢化物的稳定性越强,非金属性:O>Cl>N>S,因此H2S的稳定性最差;两种元素气态氢化物分别是NH3和HCl,发生反应NH3+HCl=NH4Cl,现象是产生白烟,NH4Cl属于离子化合物,其电子式为:![]() ;(4)D的气态氢化物是HCl,属于共价化合物,其电子式为:
;(4)D的气态氢化物是HCl,属于共价化合物,其电子式为:![]() ,A的单质为N2,两个氮原子间共用叁键,其电子式为
,A的单质为N2,两个氮原子间共用叁键,其电子式为![]() 。
。

【题目】W、X、Y、Z是短周期元素,其部分性质如下表:
W | 单质是淡黄色固体 |
X | 在地壳中的含量居第二位 |
Y | 原子最外层电子数是电子总数的2/3 |
Z | 第3周期原子半径最小的金属 |
下列说法正确的是
A. 气态氢化物的热稳定性:X>W
B. 非金属性:Y < W;离子半径:Z > W
C. W在空气中充分燃烧所得产物,可用于杀菌消毒
D. 金属Z与少量NaOH溶液反应,生成两性氢氧化物
【题目】A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
微粒 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 多核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图是_________。
(2)用电子式表示D的形成过程: ________________________
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。
(4)D与G反应的化学方程式是_________________。
(5)C粒子是_________,F粒子是_________(用电子式表示)。