题目内容
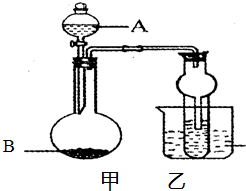
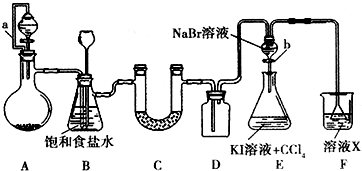 某同学设计如图所示的实验方案,请回答下列问题.
某同学设计如图所示的实验方案,请回答下列问题.(1)A装置的分液漏斗中盛装浓盐酸,烧瓶中固体为重铬酸钾(K2Cr2O7),还原产物是(CrCl3),写出A中反应的离子方程式
Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O
Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O
.(2)B装置有两个作用,分别是除去氯气中的氯化氢、
作安全瓶,防止实验过程中因导管堵塞而发生事故
作安全瓶,防止实验过程中因导管堵塞而发生事故
.拆去a导管的后果可能是浓盐酸不能顺利滴入烧瓶
浓盐酸不能顺利滴入烧瓶
.(3)U形管C中盛装的可以是
③
③
(填序号).①浓硫酸 ②碱石灰 ③无水CaCl2
(4)证明溴的非金属性比碘强的实验操作和现象是
实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色
实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色
;写出相应的离子方程式2I-+Br2=I2+2Br-
2I-+Br2=I2+2Br-
.(5)E装置中进行的实验存在明显不足,它是
没有排除氯气对溴单质与KI反应的干扰
没有排除氯气对溴单质与KI反应的干扰
,溶液X可以是①④⑥
①④⑥
(填序号).①氢氧化钠溶液②亚硫酸钠溶液③亚硫酸氢钠溶液④氯化亚铁溶液 ⑤硫氢化钠溶液 ⑥碳酸氢钠溶液.
分析:(1)反应生成氯化铬、氯气、水;
(2)浓盐酸易挥发,B起除杂作用,且B的结构决定B能作安全瓶;a导管利于液体流下;
(3)C中为固体干燥剂干燥氯气;
(4)单质之间的置换反应可比较非金属性;
(5)E装置应排除氯气的干燥,X能吸收尾气.
(2)浓盐酸易挥发,B起除杂作用,且B的结构决定B能作安全瓶;a导管利于液体流下;
(3)C中为固体干燥剂干燥氯气;
(4)单质之间的置换反应可比较非金属性;
(5)E装置应排除氯气的干燥,X能吸收尾气.
解答:解:(1)反应生成氯化铬、氯气、水,离子反应为Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O,故答案为:Cr2O72-+14H++6Cl-=2Cr3++3Cl2↑+7H2O;
(2)浓盐酸易挥发,B起除杂作用,且B的结构决定B能作安全瓶,防止实验过程中因导管堵塞而发生事故;a导管利于液体流下,若撤去a,则浓盐酸不能顺利滴入烧瓶,故答案为:作安全瓶,防止实验过程中因导管堵塞而发生事故;浓盐酸不能顺利滴入烧瓶;
(3)C中为固体干燥剂干燥氯气,只有③符合,故答案为:③;
(4)证明非金属性的反应为2I-+Br2=I2+2Br-,操作和现象为实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色,
故答案为:实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色;2I-+Br2=I2+2Br-;
(5)E装置中进行的实验存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,①④⑥能吸收氯气等有毒气体,
故答案为:没有排除氯气对溴单质与KI反应的干扰;①④⑥.
(2)浓盐酸易挥发,B起除杂作用,且B的结构决定B能作安全瓶,防止实验过程中因导管堵塞而发生事故;a导管利于液体流下,若撤去a,则浓盐酸不能顺利滴入烧瓶,故答案为:作安全瓶,防止实验过程中因导管堵塞而发生事故;浓盐酸不能顺利滴入烧瓶;
(3)C中为固体干燥剂干燥氯气,只有③符合,故答案为:③;
(4)证明非金属性的反应为2I-+Br2=I2+2Br-,操作和现象为实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色,
故答案为:实验完毕,打开活塞,使少量液体流入锥形瓶,关闭活塞,振荡锥形瓶,下层液体呈紫红色;2I-+Br2=I2+2Br-;
(5)E装置中进行的实验存在明显不足,它是没有排除氯气对溴单质与KI反应的干扰,①④⑥能吸收氯气等有毒气体,
故答案为:没有排除氯气对溴单质与KI反应的干扰;①④⑥.
点评:本题考查离子反应方程式的书写,明确实验装置及实验原理是解答的关键,注意装置中各部分的作用及发生的反应,尾气处理为解答的易错点,题目难度中等.

练习册系列答案
相关题目
 某同学设计如图所示的装置进行实验,请回答:
某同学设计如图所示的装置进行实验,请回答:(1)若试管内盛溴的四氯化碳溶液,液体A跟固体B(电石)在常温下反应,产生的气体可以使溴的四氯化碳溶液褪色,则A可能是
(2)若A为一种酸(HA)溶液,B为碳酸钠固体,试管内盛澄清的苯酚钠溶液,实验过程中观察到试管内溶液变浑浊,再加热烧杯中的水至70℃以上,观察到试管中的现象是
(3)本装置在不加热的条件下除制取乙炔外,还可以进行多种气体的制取和性质实验.请填写编号⑤栏目中的物质的名称或化学式(要求可制得的气体与示例的气体不同,而且设计要合理).
| 编号 | 液体A | 固体B | 可制得的气体 |
| ① | 浓氨水 | NaOH | NH3 |
| ② | 稀硫酸 | Zn | H2 |
| ③ | 稀盐酸 | CaC03 | C02 |
| ④ | 双氧水 | Mn02 | Q |
| ⑤ |
某同学设计如图所示的实验方案(部分夹持装置可省)
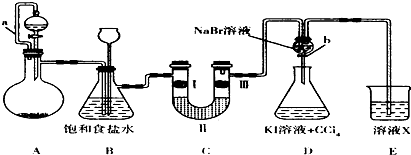
(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是(CrCl3),写出A中反应的离子方程式:
(2)拆去a导管的后果可能是 .
B装置有两个作用,分别是除去氯气中的氯化氢和安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象是
(3)装置c的功能是探究氧化性的物质是否一定有漂白性,下列最佳试剂组合是 .
(4)证明溴的非金属性比碘的强的实验操作和现象是 写出离子方程式 :
(5)溶液x宜选用下列中的
①氢氧化钠溶液 ②亚硫酸钠溶液 ③亚硫酸氢钠溶液 ④氯化亚铁溶液⑤硫氢化钠溶液 ⑥碳酸氢钠溶液.

(1)A装置的分液漏斗里盛装浓盐酸,烧瓶里固体为重铬酸钾(K2Cr207),还原产物是(CrCl3),写出A中反应的离子方程式:
(2)拆去a导管的后果可能是
B装置有两个作用,分别是除去氯气中的氯化氢和安全瓶,监测实验进行时C中是否发生堵塞,写出发生堵塞时B中的现象是
(3)装置c的功能是探究氧化性的物质是否一定有漂白性,下列最佳试剂组合是
| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 氯化钙 | 硅胶 | 氯化钠 |
| III | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
(5)溶液x宜选用下列中的
①氢氧化钠溶液 ②亚硫酸钠溶液 ③亚硫酸氢钠溶液 ④氯化亚铁溶液⑤硫氢化钠溶液 ⑥碳酸氢钠溶液.