题目内容
铅蓄电池是典型的可充电电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42— 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
Pb+PbO2+4H++2SO42—
 2PbSO4+2H2O
2PbSO4+2H2O请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
PbO2+2e-+4H++SO42—=PbSO4+2H2O 小 48
原电池正极上得电子,负极上失电子,根据原电池总反应式,正极反应为
PbO2+2e-+4H++SO42—=PbSO4+2H2O
负极:Pb-2e-+SO42—=PbSO4 质量增加
2 mol 96 g
1 mol Δm
Δm=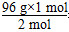 =48 g。
=48 g。
PbO2+2e-+4H++SO42—=PbSO4+2H2O
负极:Pb-2e-+SO42—=PbSO4 质量增加
2 mol 96 g
1 mol Δm
Δm=
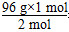 =48 g。
=48 g。
练习册系列答案
相关题目
 TiO2/S*(激发态)
TiO2/S*(激发态)

 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2