题目内容
【题目】下列各组物质,按化合物、单质、混合物顺序排列的是 ( )
A.生石灰、氯水、漂白粉B.烧碱、液氯、氨水
C.干冰、钢、空气D.盐酸、氮气、胆矾
【答案】B
【解析】
A. 氯水是氯气的水溶液,是混合物,不是单质,故A错误;
B. 烧碱、液氯、氨水分别属于化合物、单质、混合物,故B正确;
C. 钢是铁的合金,是混合物,不是单质,故C错误;
D. 盐酸是氯化氢的水溶液,是混合物,不是化合物,胆矾是纯净物,是化合物,故D错误;
故选B。

 高中必刷题系列答案
高中必刷题系列答案【题目】草酸(H2C2O4)是一种重要的有机化工原料.为探究草酸的性质,某化学研究性学习小组查阅了有关资料,有关物质的部分性质如下表:
物质 | 熔点/℃ | 性质 |
H2C2O4 | 189.5 | 有毒,具有腐蚀性,易溶于水,二元弱酸,比醋酸酸性强,100℃开始升华,157℃时开始分解.草酸与浓硫酸混合加热产生CO2,CO和H2O.草酸钙和草酸氢钙均为白色难溶物 |
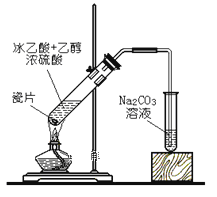
[实验一]根据下图提供的仪器和试剂(可重复使用),设计实验证明草酸与浓硫酸混合加热产物中含有CO2和CO(部分夹持仪器和加热装置省略)。
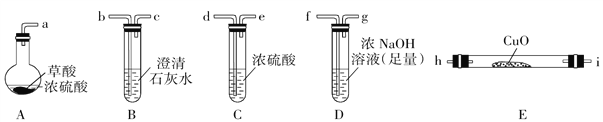
(1)仪器接口依次连接的合理顺序为a→____________________________.
(2)用上图提供的仪器和试剂做实验时,首次使用的装置B中出现白色浑浊,并不能说明草酸受热分解产物中一定有CO2,请你提出改进意见:__________________.
(3)利用改进后的装置进行实验时,要先加热______装置(填装置标号,下同)后加热______装置.
[实验二]利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.
(4)实验时,先分别量取两种溶液,然后倒入试管中,迅速振荡混匀并开始计时,通过测定溶液褪色所需的时间来判断反应的快慢.该小组设计了如下的方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/ mol·L-1 | 体积/mL | 浓度/ mol·L-1 | 体积/mL | ||
1 | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
2 | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
3 | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
①已知反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需满足的关系为n(H2C2O4)/n(KMnO4) ≥__________.
②探究温度对化学反应速率影响的实验编号是__________,探究反应物浓度对化学反应速率影响的实验编号是__________.
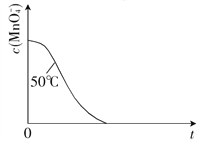
③已知50℃时c(MnO![]() )-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO
)-t(反应时间)的变化曲线如图.若保持其他条件不变,请在图中画出25℃时c(MnO![]() )-t的变化曲线示意图并注明温度.
)-t的变化曲线示意图并注明温度.