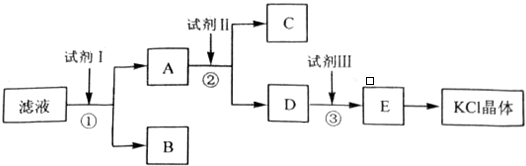
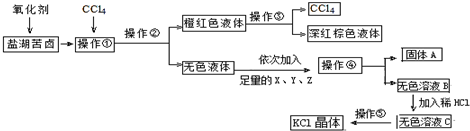
题目内容
18.工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生成过程.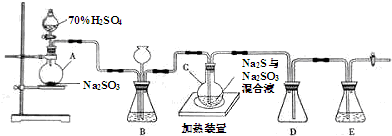
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若液柱高度保持不变,则整个装置气密性良好.装置D的作用是防止倒吸.装置E中为NaOH溶液.
(2)装置A中反应的化学方程式为Na2SO3+H2SO4═Na2SO4+SO2↑+H2O.
烧瓶C中发生反应如下:
Na2S+H2O+SO2=Na2SO3+H2S (Ⅰ)
2H2S+SO2=3S+2H2O (Ⅱ)
S+Na2SO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3 (Ⅲ)
为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为2:1.
分析 (1)液柱高度保持不变,说明气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用;
(2)根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3.
解答 解:(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若液柱高度保持不变,则气密性良好;D中左侧为短导管,为安全瓶,防止倒吸;装置E起到吸收尾气中SO2、H2S的作用,可选用NaOH溶液,
故答案为:液柱高度保持不变;防止倒吸;NaOH;
(2)装置A中反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,根据题目所给3个反应,可得出对应关系:2Na2S~2H2S~3S~3 Na2SO3,2Na2S反应时同时生成2Na2SO3,还需要1Na2SO3,所以烧瓶C中Na2S和Na2SO3物质的量之比为2:1,
故答案为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;2:1.
点评 本题考查实验方案的分析与评价,涉及气密性检验、离子检验、对操作的分析评价、化学计算等,侧重实验分析能力及知识综合应用能力的考查,(2)为易错点,可以利用总反应的分析,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
9.下列各组物质中,互为同位素的是( )
| A. | T2O与D2O | B. | 4019K与4020Ca | ||
| C. | O2和O3 | D. | ${\;}_{6}^{12}$C和${\;}_{6}^{14}$C |
6.化学为人类基本的生存需要、进而追求生活乃至生命质量的提升提供了重要的保障.但某些人的贪得无厌和对化学原理的滥用败坏了化学学科声誉,我们每个人都应该避免成为这样的人.下列科学史上的重要发现与发明,从原理上看与化学学科没有直接相关性的是( )
| A. | 1774年舍勒最早制得氯气,1820年前后漂白粉用于饮用水消毒 | |
| B. | 1869年门捷列夫发现元素周期律,使元素的性质更有规律可循 | |
| C. | 1902年哈伯开始对合成氨反应进行研究,工业化后提高了粮食产量 | |
| D. | 1942年费米进行了235U原子核裂变试验,从而开创原子能利用时代 |
13.X、Y、Z均为短周期元索,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 单质活泼性:X>Y>Z | ||
| C. | 原子序数:X>Y>Z | D. | 离子半径:X2->Y+>Z- |
3.下列实验现象预测正确的是( )
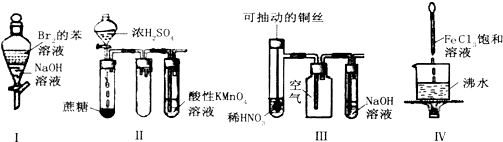

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
10.NA表示阿伏加德罗常数.下列说法中正确的是( )
| A. | 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA | |
| B. | 6.2gNa2O和7.8gNa2O2混合物中所含有的阴离子数为0.3 NA | |
| C. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023 | |
| D. | 18g D2O(重水)完全电解,转移6.02×1023个电子 |
7.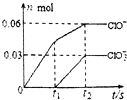 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )
将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO${\;}_{3}^{-}$两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法正确的是( )| A. | 苛性钾溶液中KOH的质量是4.94g | |
| B. | 反应中转移电子的物质的量是0.21mol | |
| C. | Cl-的物质的量为0.09mol | |
| D. | ClO${\;}_{3}^{-}$的生成是由于KOH过量引起的 |