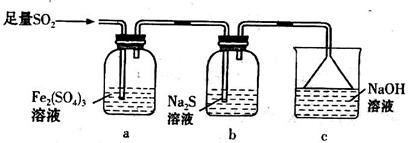
题目内容
下列关于SO2性质的分析,正确的是
| A.通入BaCl2溶液中,有白色沉淀生成 | B.通入FeCl3溶液中,有SO42-生成 |
| C.通入氯水中,有淡黄色沉淀生成 | D.通入KI溶液中,有I2生成 |
B
试题分析:A、SO2不与BaCl2溶液反应,错误;B、FeCl3溶液中
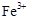 具有较强的氧化性,能把SO2氧化成SO42-,正确;C、氯水中氧化性物质如氯气能把SO2氧化成SO42-,不会有淡黄色沉淀生成,错误;D、KI溶液与SO2不反应,错误。
具有较强的氧化性,能把SO2氧化成SO42-,正确;C、氯水中氧化性物质如氯气能把SO2氧化成SO42-,不会有淡黄色沉淀生成,错误;D、KI溶液与SO2不反应,错误。
练习册系列答案
相关题目

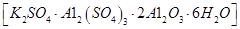 制备无水氯化铝的流程如下:
制备无水氯化铝的流程如下: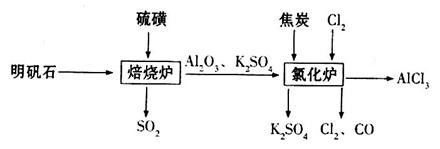
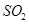 的方法是________________________________。
的方法是________________________________。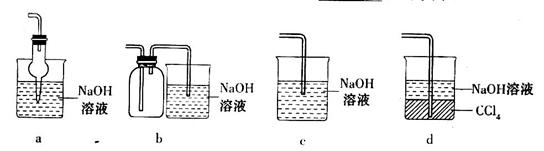
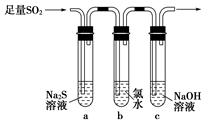
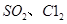 等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)
等大气污染物,若将二者按照一定比例通入水中可减少或消除污染。试设计简单实验检验二者是否恰好完全反应。(简要描述实验步骤、现象和结论)