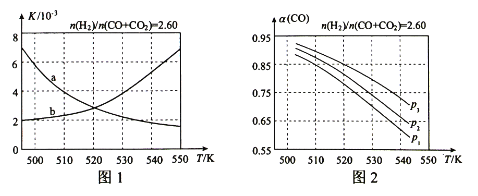
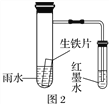
题目内容
【题目】分别按下图A、B、C所示装置进行实验,图中三个烧杯里的溶液为同浓度的稀硫酸。请回答下列问题:

(1)以下叙述中,正确的是__________。
A.B中铁片是负极,C中铁片是正极
B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率A中比B中慢
D.B溶液中SO42-向铁片电极移动
(2)装置B变化过程中能量转化的形式主要是:____________。
(3)装置B中正极反应式为____________,负极反应式为____________。
(4)有同学想把Ba(OH)2·8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?__________(填“是”或“否”),理由是__________。
【答案】 ACD 化学能转化为电能 2H++2e-=H2↑ Fe-2e-=Fe2+ 否 不是氧化还原反应
【解析】(1)活动性:Zn>Fe>Sn活沷性强的金属易失电子作负极,故A正确;B、A烧杯中铁直接反应表面有气泡,C中铁作正极,烧杯中铁表面有气泡,故B错误;C、B形成原电池,比A中反应速率快,产生气泡的速率A中比B中慢,故C正确;D、原电池中阴离子移向负极,B中Fe是负极,B溶液中SO42-向铁片电极移动,故D正确;故选ACD。(2)装置B形成原电池,变化过程中能量转化的形式主要是:化学能转化为电能;(3)Sn作正极,正极上氢离子得电子生成氢气装置B中正极反应式为 2H++2e-=H2↑,活泼金属锌作负极,电极反应为Fe,负极反应式为Fe-2e-=Fe2+ ;(4)常温下自法进行的氧化还原反应,且为放热反应可设计成原电池,而Ba(OH)2·8H2O晶体与NH4Cl晶体的反应为吸热反应,且为非氧化还原反应,则不能设计成原电池。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案【题目】某溶液只含下表离子中的几种,且各离子的物质的景浓度相等(不考虑水的电离与离子水解)。
阳离子 | K+、NH4+、Fe2+、Mg2+、Cu2+ |
阴离子 | OH -、CI-、CO32-、SO42 - |
某同学进行了如下实验(必要时可加热):

下列说法正确的是
A. 由沉淀A推断原溶液中一定含有SO42- B. 原溶液中只含有NH4+、Fe2+、Cl-、SO42-
C. 泣液A中可能含有K+ D. 沉淀B中一定含有Mg(OH)2