题目内容
6.如表是A、B二种有机物的有关信息;| A | B |
| ①能使含溴的四氯化碳溶液褪色; ②比例模型为: 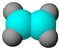 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为:  |
(1)A与含溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式nCH2═CH2$\stackrel{催化剂}{→}$
 .
.(2)A与氢气发生加成反应后生成C,C在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是①②③(填序号):
①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;
(4)写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$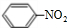 +H2O.
+H2O.
分析 A结构符合下列条件,①能使溴的四氯化碳溶液褪色,说明含有不饱和键,②比例模型为: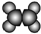 ,③能与水在一定条件下反应生成醇,则A为乙烯,其结构简式为CH2=CH2;B符合下列条件,①由C、H两种元素组成说明属于烃,②球棍模型为:
,③能与水在一定条件下反应生成醇,则A为乙烯,其结构简式为CH2=CH2;B符合下列条件,①由C、H两种元素组成说明属于烃,②球棍模型为: ,则B为苯,
,则B为苯,
(1)A是乙烯,乙烯和溴发生加成反应生成1,2-二溴乙烷,乙烯发生加聚反应生成聚乙烯;
(2)乙烯与氢气发生加成反应后生成分子乙烷,乙烷在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们属于烷烃,它们均符合通式CnH2n+2,从丁烷开始出现同分异构体;
(3)B是苯,苯是无色无味液体、有毒、不溶于水,密度小于水,和强酸、强碱、强氧化剂不反应,一定条件下能发生加成反应;
(4)浓硫酸作催化剂、加热条件下,苯与浓硝酸发生取代反应生成硝基苯;
解答 解:A结构符合下列条件,①能使溴的四氯化碳溶液褪色,说明含有不饱和键,②比例模型为: ,③能与水在一定条件下反应生成醇,则A为乙烯,其结构简式为CH2=CH2;B符合下列条件,①由C、H两种元素组成说明属于烃,②球棍模型为:
,③能与水在一定条件下反应生成醇,则A为乙烯,其结构简式为CH2=CH2;B符合下列条件,①由C、H两种元素组成说明属于烃,②球棍模型为: ,则B为苯,
,则B为苯,
(1)A是乙烯,乙烯和溴发生加成反应生成1,2-二溴乙烷,乙烯发生加聚反应生成聚乙烯,反应方程式为nCH2═CH2$\stackrel{催化剂}{→}$ ,
,
故答案为:1,2-二溴乙烷;nCH2═CH2$\stackrel{催化剂}{→}$ ;
;
(2)乙烯与氢气发生加成反应后生成分子乙烷,乙烷在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们属于烷烃,它们均符合通式CnH2n+2,从丁烷开始出现同分异构体,所以n=4,
故答案为:4;
(3)B是苯,苯是无色无味液体、有毒、不溶于水,密度小于水,和强酸、强碱、强氧化剂不反应,一定条件下能发生加成反应,
故选①②③;
(4)浓硫酸作催化剂、加热条件下,苯与浓硝酸发生取代反应生成硝基苯,反应方程式为 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$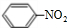 +H2O,
+H2O,
故答案为: +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$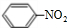 +H2O;
+H2O;
点评 本题考查有机物推断,熟悉有机物结构、性质是解本题关键,熟练掌握烃、卤代烃、醇、醛、羧酸、酯之间的转化,注意苯和硝酸发生取代反应时硝基的书写方法,难点是同分异构体种类的判断,有碳链异构、官能团有关等,题目难度不大

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案| A. | H2SO4和Ba(OH)2 | B. | CO2和NaOH | C. | CaCO3和HCl | D. | Na2CO3和K2SO4 |
(1)如表列出了三种牙膏中的摩擦剂.请在表中填写三种摩擦剂所属的物质类别(指酸、碱、盐、氧化物)
| 儿童牙膏 | 防臭牙膏 | 透明牙膏 | |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 氧化硅 |
| 物质类别 | 碱 | 盐 | 氧化物 |
 ,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.
,请写出氟化钠在水溶液中的电离方程式NaF=Na++F-.(3)“84”消毒液的主要成分是次氯酸钠(NaClO),洁厕灵的主要成分是盐酸(HCl).据网络报道:“84”消毒液+洁厕灵→夺命毒气+水+氯化钠,因此在使用时应避免将两种物质混合.试写出“84”消毒液和洁厕灵混合时产生夺命毒气的化学方程式:NaClO+2HCl=NaCl+Cl2↑+H2O.
(4)使用漂白粉溶液除去白色衣物上的色斑,往往需要将衣物浸泡在其中且露置在空气中30分钟,再进行洗涤效果更好,用化学方程式表示其使用原理Ca(ClO)2+CO2+H2O=CaCO3+2HClO.
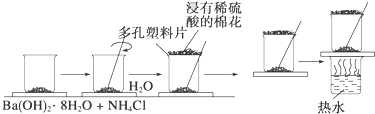
在一个小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据实验步骤,填写下表,并回答问题.
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的 ①产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是 ②反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有 ③生成 |
④写出实验过程中发生反应的化学方程式:BaCl2•8H2O+2NH4Cl═BaCl2+2NH3•H2O+8H2O.
⑤实验中要立即用玻璃棒迅速搅拌的原因是:使反应物迅速混合而充分反应,使温度迅速下降.
⑥在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?反应过程中产生对人体有害的气体,会对环境造成污染,故应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的NH3.
| A. | 羟甲基(-CH2OH)和甲氧基(CH3O-) | B. | S2-和Cl- | ||
| C. | Mg2+和F- | D. | 羟基(-OH)和氢氧根(OH-) |
| A. | 化学平衡常数是指在一定温度下生成物浓度幂之积与反应物浓度幂之积的比值 | |
| B. | 勒夏特列原理指的是,如果改变影响平衡的条件之一(如温度、压强、参与反应物质的浓度,),平衡将向着能够减弱这种改变的方向移动 | |
| C. | 盐溶液不一定呈中性,不显中性的盐都会促进水的电离 | |
| D. | 把被保护的钢铁设备作为电解池的阴极,该方法称为牺牲阳极的阴极保护法 |
| A. | 甲基的电子式: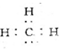 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 葡萄糖的实验式CH2O | D. | 硝基苯的结构简式: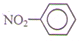 |
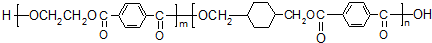
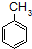 $\stackrel{KMnO_{4}/H+}{→}$
$\stackrel{KMnO_{4}/H+}{→}$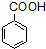
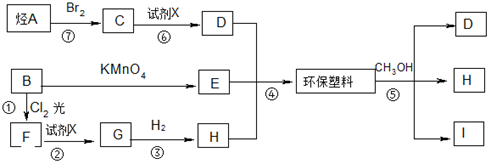
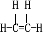 ;
;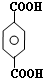 ;B的名称:对二甲苯,试剂X为NaOH水溶液.
;B的名称:对二甲苯,试剂X为NaOH水溶液.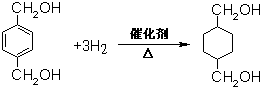 .
.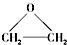 ),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$
),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$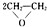 .
.