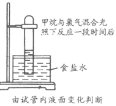
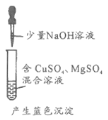
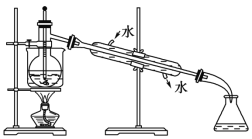
题目内容
【题目】如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C可能是下列各组中的

A.A是Ag,B是Fe,C为稀AgNO3溶液
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Zn,B是Cu,C为稀H2SO4
【答案】A
【解析】
A.若A是Ag,B是Fe,C为稀AgNO3溶液,则电池总反应为Fe+2AgNO3=Fe(NO3)2+2Ag,Fe电极上铁单质放电生成亚铁离子,电极变细,银电极上银离子放电生成银单质,电极变粗,故A符合题意;
B.若A是Cu,B是Zn,C为稀H2SO4,则电池总反应为Zn+H2SO4=ZnSO4+H2↑,铜电极上氢离子放电生成氢气,电极粗细不变,故B不符合题意;
C.若A是Fe,B是Ag,C为稀AgNO3溶液,则电池总反应为Fe+2AgNO3=Fe(NO3)2+2Ag,Fe电极上铁单质放电生成亚铁离子,电极变细,银电极上银离子放电生成银单质,电极变粗,则A变细,B变粗,故C不符合题意;
D.若A是Zn,B是Cu,C为稀H2SO4,则电池总反应为Zn+H2SO4=ZnSO4+H2↑,Zn电极上Zn失电子放电生成Zn2+,铜电极上氢离子放电生成氢气,,则A变细,B不变,故D不符合题意;
故答案为A。

 阳光课堂课时作业系列答案
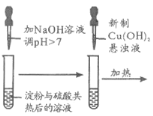
阳光课堂课时作业系列答案【题目】下列方案设计能达到实验目的的是
A | B | C | D |
检验淀粉是否水解 | 由褪色快慢研究反应物浓度对反应速率的影响 | 证明发生了取代反应 | 验证Ksp[Cu(OH)2]<Ksp[Mg(OH)2 ] |
|
|
|
|
A.AB.BC.CD.D
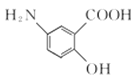
【题目】(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)=ETBE(g) △H。回答下列问题:
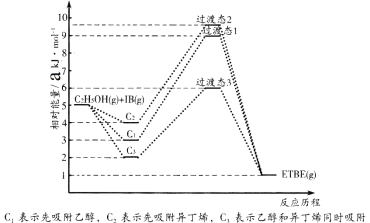
反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的△H=__________ kJ·mol-1。反应历程的最优途径是________(填C1、C2或C3)。
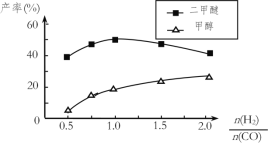
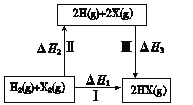
(2)开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
反应ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1=-99kJ·mol1
反应ⅱ:2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol1
反应ⅲ:CO(g)+H2O(g)CO2(g)+H2(g) ΔH3=-41.2kJ·mol1
①在该条件下,若反应1的起始浓度分别为:c(CO)=0.6mol·L1,c(H2)=1.4mol·L1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为__________。
②在t℃时,反应2的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
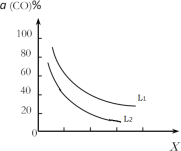
③催化反应室的总反应3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),CO的平衡转化率α(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)。
④在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。
的改变,二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:______________。