题目内容
【题目】在25 ℃时,用蒸馏水稀释1 mol·L-1的醋酸溶液至0.01 mol·L-1,随着溶液的稀释,下列各项中始终保持增大趋势的是( )
A.  B.
B. 
C.  D.
D. 
【答案】A
【解析】醋酸是弱电解质,在水溶液中存在电离平衡,加水稀释促进醋酸电离,所以溶液中c(CH3COOH)减小,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(CH3COO-)、c(H+)都减小,温度不变水的离子积常数不变,所以c(OH-)增大。
A.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,因为溶液体积相同,所以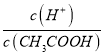 增大,故A正确;B.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,溶液体积相等,所以
增大,故A正确;B.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小、n(H+)增大,溶液体积相等,所以 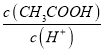 减小,故B错误;C.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小,n(CH3COO-)增大,溶液体积相等,所以
减小,故B错误;C.加水稀释促进醋酸电离,所以溶液中n(CH3COOH)减小,n(CH3COO-)增大,溶液体积相等,所以 减小,故C错误;D.
减小,故C错误;D. 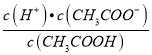 =Ka,温度不变,电离平衡常数不变,所以
=Ka,温度不变,电离平衡常数不变,所以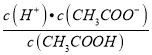 不变,故D错误;故选A。
不变,故D错误;故选A。

【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D
【题目】要使工业废水中的重金属离子Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等做沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用的沉淀剂最好为( )
A. 碳酸盐 B. 硫酸盐 C. 硫化物 D. 以上沉淀剂均可


