题目内容
【题目】某菱铁矿的主要成分是FeCO3,还含有SiO2、少量CaCO3和 Al2O3。下图是利用该菱铁矿制备磁性Fe3O4胶体粒子的简要工艺流程:
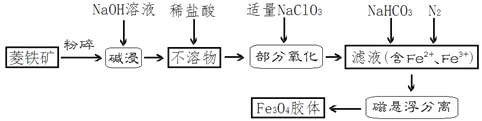
(1)菱铁矿石粉碎的目的是______________________________;碱浸可否用较便宜的Ca(OH)2替代NaOH?说明理由:______________________________________________。
(2) “不溶物”加稀盐酸可否改用不易挥发的稀硫酸?说明理由___________________________________________;“不溶物”加稀盐酸后“部分氧化”之前还有项操作,化学实验名称为__________。
(3) “部分氧化”离子方程式为________________________________________。
(4)如何实验验证“部分氧化”的滤液中存在Fe2+?__________________________________________________________________________________。
(5)Fe3O4胶粒的直径的范围是______________________。
【答案】 增大固体表面积,提升“碱浸”时的化学反应速率 不能,Ca(OH)2溶解度较小不能顺利溶解铁矿中的Al2O3 不可,CaSO4微溶很难除净固体中的CaCO3 过滤 ClO3- + 6H+ + 6Fe2+ = Cl- + 6Fe3+ + 3H2O 往试样中滴加高锰酸钾酸性溶液,高锰酸钾紫红色褪去,说明滤液中尚存Fe2+(或其它合理答案) 1~100nm(或10-9~10-7m等合理答案)
【解析】(1)颗粒越小,颗粒比比表面积越大,越有利于提高反应的速率;不能,用Ca(OH)2替代NaOH,因为Ca(OH)2在水中溶解度较小,不足以溶解铁矿中的Al2O3;
(2)不能,因为加入的稀硫酸会生成CaSO4,其微溶于水,不利于固体中的CaCO3的溶解;化学试验名称为过滤,出去将溶液中SiO2和Fe(OH)2过滤出来。
(3)“部分氧化”为ClO3-将2价铁氧化,同时Cl元素被还原为Cl-,反应的离子方程式为:ClO3- + 6H+ + 6Fe2+ = Cl- + 6Fe3+ + 3H2O。
(4)检验三价铁中的二价铁最常考的方法是:滴加KMnO4的酸性溶液,红色退去,证明含Fe2+;
(5)因为Fe3O4为胶体,其胶粒直径的范围为1~100nm,粒子直径小于1nm的为溶液,大于100nm的为浊液。

 智慧小复习系列答案
智慧小复习系列答案【题目】目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究。已知在不同温度下的化学反应平衡常数(K1、K2、K3)如下表所示:
化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
500 | 700 | 800 | |||
①2H2(g)+CO(g) | ΔH1 | K1 | 2.5 | 0.34 | 0.15 |
②CO2(g)+H2(g) | ΔH2 | K2 | 1.0 | 1.70 | 2.52 |
③CO2(g)+3H2(g) | ΔH3 | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=________(用K1、K2表示);根据反应③判断ΔS___0(填“>”、“=”或“<”),在______(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0.1mol/L、0.8mol/L、0.3mol/L、0.15mol/L
【题目】(1)已知下列物质在20℃下的Ksp如下,试回答下列问题:
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 货色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①20℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是______________。
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时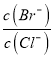 =_____________。
=_____________。
③测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是_______。
A.KBr B.KI C.K2S D.K2CrO4
(2)已知25℃时Ksp[Mg(OH)2]=5.6×10-12,Ksp[Cu(OH)2]=2.2×10-20
Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33。
①在25℃下,向浓度均为0.1mol·L-1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成____沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×10-5mol·L-1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2mol·L-1。此时所得沉淀中 (填“还含有”或“不含有”) Al(OH)3,并请写出计算过程。
③根据25℃时Mg(OH)2的Ksp,计算该温度下反应Mg(OH)2+2H+![]() Mg2++2H2O的平衡常数K=________。
Mg2++2H2O的平衡常数K=________。