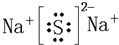题目内容
现有下更短周期元素性质的数据:
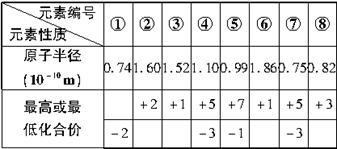
请确定以上8种元素在周期表中的位置,将元素的编号填入下表中:

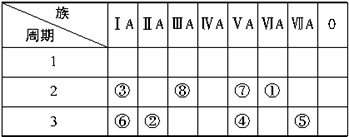
解析:
先根据元素的化合价确定元素可能所在的族数,再根据同周期、同主族原子半径的变化规律,准确确定元素在周期表中的位置。如④和⑦元素,最高正价为+5价,负价为-3价,可能位于第ⅤA族,又④号元素的原子半径(1.10×10-10m)>⑦号元素的原子半径(0.75×10-10m),所以④号元素位于第3周期第ⅤA族,⑦号元素位于第2周期第ⅤA族,同理可推出其他元素的位置。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目